قررت جمعية نوبل منح جائزة نوبل في الكيمياء لعام 2024 مناصفة بين الأمريكي “ديفيد بيكر” والإنجليزيان “ديميس هاسابيس” و”جون جامبر”. حيث نجح ديميس هاسابيس وجون جامبر في استخدام الذكاء الاصطناعي للتنبؤ ببنية جميع البروتينات المعروفة تقريبًا، بينما طور ديفيد بيكر طرقًا محوسبة لإنشاء بروتينات بوظائف جديدة تمامًا. إن ما فعله هؤلاء الثلاثة لديه القدرة على تغيير فهمنا للحياة والعالم من حولنا. حيث أن تطبيقات هذا الإنجاز واسعة ومتنوعة. كما أن الفائزين الثلاثة قد توقعت كلاريفت أن يفوزوا بجائزة نوبل هذا العام في الكيمياء.
محتويات المقال :
البروتينات
البروتينات هي الأدوات الكيميائية الرائعة للحياة، وهي مبنية من 20 حمضًا أمينيًا يمكن دمجها بطرق لا حصر لها. وباستخدام المعلومات المخزنة في الحمض النووي كمخطط، ترتبط هذه الأحماض الأمينية معًا في خلايانا لتشكل خيوطًا طويلة. بعد ذلك، يحدث سحر البروتينات حيث تلتف سلسلة الأحماض الأمينية وتنثني لتشكل بنية متميزة، وفريدة ثلاثية الأبعاد.
هذا الهيكل هو الذي يعطي البروتينات وظيفتها. حيث يتحول بعضها إلى وحدات بناء كيميائية يمكنها تكوين العضلات أو القرون أو الريش، بينما قد يتحول بعضها الآخر إلى هرمونات أو أجسام مضادة. ويشكل العديد منها إنزيمات تدفع التفاعلات الكيميائية في الحياة بدقة مذهلة. والبروتينات التي تستقر على أسطح الخلايا مهمة أيضاً، وتعمل كقنوات اتصال بين الخلية ومحيطها. لا يمكن أن ننكر أهمية البروتينات. إنها اللبنات الأساسية للحياة، وفهم بنيتها ووظيفتها أمر بالغ الأهمية لكشف أسرار الحياة.
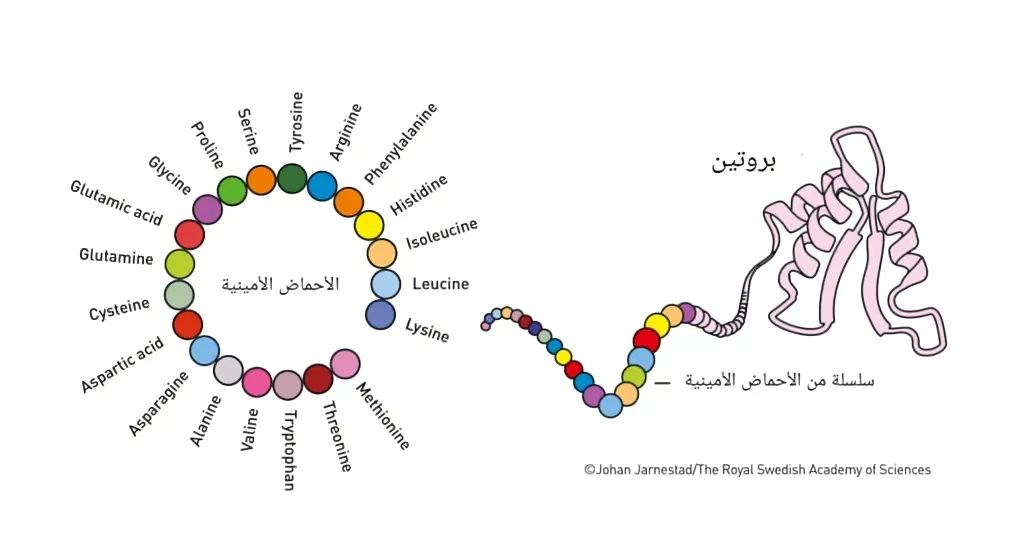
التنبؤ ببنية البروتين
لأكثر من خمسة عقود، ناضل العلماء للتنبؤ ببنية البروتينات من خلال تسلسل الأحماض الأمينية الخاصة بها. كان هذا التحدي، المعروف باسم “مشكلة طي البروتين” (protein folding problem)، عقبة رئيسية في فهم تعقيدات البروتينات. إن القدرة على التنبؤ ببنية البروتين لها آثار بعيدة المدى، لأنها ستمكن الباحثين من تصميم بروتينات جديدة ذات وظائف محددة، وفهم أسباب الأمراض، وتطوير أدوية أكثر فعالية.
بدأت رحلة حل هذا اللغز في الستينيات، عندما استخدم العلماء لأول مرة دراسة البلورات بالأشعة السينية لتحديد البنية ثلاثية الأبعاد للبروتينات. وعلى الرغم من أن هذه الطريقة رائدة، إلا أنها كانت شاقة ومحدودة. وقد استخدم الباحثون في المقام الأول دراسة البلورات بالأشعة السينية، وكثيراً من الجهد، لإنتاج صور ناجحة لنحو 200 ألف بروتين مختلف، وهو ما وضع الأساس لجائزة نوبل في الكيمياء لعام 2024.
ثم توصل كريستيان أنفينسن، وهو عالم أمريكي، إلى اكتشاف مذهل. فباستخدام حيل كيميائية مختلفة، تمكن من جعل بروتين موجود يتكشف (unfold) ثم يطوي نفسه مرة أخرى. وكانت الملاحظة المثيرة للاهتمام هي أن البروتين يتخذ نفس الشكل بالضبط في كل مرة. وفي عام 1961، خلص إلى أن البنية ثلاثية الأبعاد للبروتين تحكمها بالكامل تسلسل الأحماض الأمينية في البروتين. وقد أدى هذا إلى منحه جائزة نوبل في الكيمياء عام 1972.
ومع ذلك، فإن منطق أنفينسن يحتوي على مفارقة، أشار إليها أمريكي آخر، وهو سايروس ليفينثال، في عام 1969. فقد أشار حساباته أنه حتى إذا كان البروتين يتكون من 100 حمض أميني فقط، فمن الناحية النظرية يمكن للبروتين أن يتخذ ما لا يقل عن 47^10 بنية ثلاثية الأبعاد مختلفة. وإذا كانت سلسلة الأحماض الأمينية تنطوي عشوائيًا، فسيستغرق الأمر وقتًا أطول من عمر الكون للعثور على البنية البروتينية الصحيحة. ولكن في الخلية، يستغرق الأمر بضعة مللي ثانية فقط. فكيف تنطوي سلسلة الأحماض الأمينية فعليًا؟
يشير اكتشاف أنفينسن ومفارقة ليفينثال إلى أن الطي عملية محددة مسبقًا. والأهم من ذلك، يجب أن تكون جميع المعلومات حول كيفية طي البروتين موجودة في تسلسل الأحماض الأمينية. وتهدف مسابقة التقدير التوقعي لبنية البروتين (CASP)، التي تم إطلاقها في عام 1994، إلى تسريع التقدم في مجال توقع بنية البروتين من خلال تعزيز التعاون والابتكار.
ألفافولد نجمة نوبل الكيمياء 2024 الأولى
في عام 2010، شارك ديميس هاسابيس في تأسيس شركة (DeepMind)، وهي شركة طورت نماذج ذكاء اصطناعي بارعة للألعاب اللوحية المشهورة. تم بيع الشركة إلى جوجل في عام 2014، وبعد عامين، لفتت (DeepMind) الانتباه العالمي عندما حققت الشركة ما اعتقده الكثيرون آنذاك أنه طفرة للذكاء الاصطناعي، وهو التغلب على بطل إحدى أقدم الألعاب اللوحية في العالم، المعروفة باسم جو.
ومع ذلك، بالنسبة لهاسابيس، لم تكن جو هي الهدف، بل كانت الوسيلة لتطوير نماذج ذكاء اصطناعي أفضل. وبعد هذا الانتصار، كان فريقه مستعدًا لمعالجة مشاكل ذات أهمية أكبر للإنسانية، لذلك في عام 2018 سجل في مسابقة (CASP) الثالثة عشرة.
في السنوات السابقة، حققت هياكل البروتين التي توقعها الباحثون لـ(CASP) دقة 40 %، في أفضل الأحوال. وباستخدام نموذج الذكاء الاصطناعي الخاص بهم، المسمى ألفافولد (AlphaFold)، وصل فريق هاسابيس إلى ما يقرب من 60 %. لقد فازوا، وكانت النتيجة الممتازة مفاجأة للعديد من الناس وكان تقدمًا غير متوقع، لكن الحل لم يكن جيدًا بما فيه الكفاية. ولكي ينجح التنبؤ، كان لابد أن تكون دقته 90% عند مقارنته بالهيكل المستهدف.
واصل هاسابيس وفريقه تطوير ألفافولد، ولكن على الرغم من محاولاتهم الجادة، لم تصل الخوارزمية إلى الشكل المرغوب. وكانت الحقيقة المؤلمة أنهم وصلوا إلى طريق مسدود. كان الفريق مُتعبًا، لكن أحد الموظفين الجدد نسبيًا كان لديه أفكار حاسمة حول كيفية تحسين نموذج الذكاء الاصطناعي. هذا الموظف هو جون جامبر.
جون جامبر وطريقه لنوبل الكيمياء 2024
كانت النسخة الجديدة، ألفافولد 2، تمتلك بصمات معرفة جامبر بالبروتينات. حيث بدأ الفريق أيضًا في استخدام الابتكار وراء التقدم الهائل الأخير في الذكاء الاصطناعي، الشبكات العصبية المسماة المُحوِّلات (transformers). يمكن لهذه الشبكات العثور على أنماط في كميات هائلة من البيانات بطريقة أكثر مرونة من ذي قبل، وتحديد ما يجب التركيز عليه بكفاءة لتحقيق هدف معين.
قام الفريق بتدريب ألفافولد 2 على المعلومات الهائلة في قواعد البيانات لجميع هياكل البروتين وتسلسلات الأحماض الأمينية المعروفة وبدأت بنية الذكاء الاصطناعي الجديدة في تقديم نتائج جيدة في الوقت المناسب لمسابقة (CASP) الرابعة عشرة.
في عام 2020، عندما قام منظمو (CASP) بتقييم النتائج، لقد فهموا أن تحدي الكيمياء الحيوية الذي دام 50 عامًا قد انتهى. ففي معظم الحالات، كان أداء ألفافولد 2 جيدًا تقريبًا مثل دراسة البلورات بالأشعة السينية، وهو أمر مذهل.
كيف يعمل ألفافولد 2؟
كجزء من تطوير ألفافولد 2، تم تدريب نموذج الذكاء الاصطناعي على جميع تسلسلات الأحماض الأمينية المعروفة وهياكل البروتين المحددة.
- إدخال البيانات وعمليات البحث في قواعد البيانات: يتم إدخال تسلسل الأحماض الأمينية ذي البنية غير المعروفة إلى ألفافولد 2، الذي يبحث في قواعد البيانات عن تسلسلات الأحماض الأمينية وهياكل البروتين المماثلة.
- تحليل التسلسل: يقوم نموذج الذكاء الاصطناعي بمحاذاة جميع تسلسلات الأحماض الأمينية المتشابهة، غالبًا من أنواع مختلفة، ويبحث في الأجزاء التي تم الحفاظ عليها
- في الخطوة التالية، يستكشف ألفافولد 2 الأحماض الأمينية التي يمكن أن تتفاعل مع بعضها البعض في بنية البروتين ثلاثية الأبعاد. تتطور الأحماض الأمينية المتفاعلة معًا. إذا كان أحدهما مشحونًا، فإن الآخر يحمل شحنة معاكسة، وبالتالي ينجذبان إلى بعضهما البعض. وإذا تم استبدال أحدهما بحمض أميني كاره للماء (hydrophobic)، فإن الآخر يصبح أيضًا كارهًا للماء.
- تحليل الذكاء الاصطناعي: باستخدام طريقة تكرارية (iterative process)، يقوم ألفافولد 2 بتحسين تحليل التسلسل وخريطة المسافة. حيث يستخدم نموذج الذكاء الاصطناعي شبكات عصبية تسمى المحولات، والتي تتمتع بقدرة كبيرة على تحديد العناصر المهمة التي يجب التركيز عليها. كما يتم استخدام البيانات حول هياكل البروتين الأخرى إذا تم العثور عليها في الخطوة الأولى.
- البنية الافتراضية: يجمع برنامج ألفافولد 2 أحاجي من جميع الأحماض الأمينية ويختبر المسارات لإنتاج بنية بروتينية افتراضية. ويتم إعادة تشغيل هذه العملية من خلال الخطوة الرابعة. بعد ثلاث دورات، يصل برنامج ألفافولد 2 إلى بنية معينة. ويحسب نموذج الذكاء الاصطناعي احتمالية أن تتوافق أجزاء مختلفة من هذه البنية مع الواقع.
ألفافولد 2 متاح للجميع
عندما تأكد ديميس هاسابيس وجون جامبر أن ألفافولد 2 يعمل حقًا، حسبا بنية جميع البروتينات البشرية. ثم توقعا بنية جميع البروتينات البالغ عددها 200 مليون بروتين تقريبًا والتي اكتشفها الباحثون حتى الآن عند رسم خرائط الكائنات الحية على الأرض.
كما جعلت (Google DeepMind) الكود الخاص بألفافولد 2 متاحًا للجمهور، ويمكن لأي شخص الوصول إليه. حيث أصبح نموذج الذكاء الاصطناعي منجمًا ذهبيًا للباحثين. وبحلول أكتوبر 2024، تم استخدام ألفافولد 2 من قبل أكثر من مليوني شخص من 190 دولة.
في السابق، كان الحصول على بنية البروتين يستغرق سنوات غالبًا، إن وجد. والآن يمكن القيام بذلك في بضع دقائق. إن نموذج الذكاء الاصطناعي ليس مثاليًا، لكنه يقدر صحة البنية التي أنتجها، لذلك يعرف الباحثون مدى موثوقية التنبؤ.
الآن سنعود بالزمن إلى الوراء ونلقي الضوء على مشارك آخر في (CASP). دعونا نقدم النصف الآخر من جائزة نوبل في الكيمياء لعام 2024، والتي تتناول إنشاء بروتينات جديدة من الصفر.
روزيتا نجمة نوبل الكيمياء 2024 الثانية
شارك بيكر لأول مرة في مسابقة (CASP) في عام 1998 باستخدام روزيتا (Rosetta)، وهو برنامج كمبيوتر طوره بيكر يمكنه التنبؤ بهياكل البروتينات. وبالمقارنة مع المشاركين الآخرين، كان أداء البرنامج جيدًا حقًا. أدى هذا النجاح إلى فكرة جديدة، وهي أن فريق ديفيد بيكر يمكنه استخدام البرنامج في الاتجاه المعاكس. فبدلاً من إدخال تسلسلات الأحماض الأمينية في روزيتا واستخراج هياكل البروتين، يجب أن يكونوا قادرين على إدخال بنية البروتين المرغوبة والحصول على اقتراحات لتسلسل الأحماض الأمينية، مما يسمح لهم بإنشاء بروتينات جديدة تمامًا.
بدأ مجال تصميم البروتينات، حيث يبتكر الباحثون بروتينات مخصصة ذات وظائف جديدة، في الظهور في نهاية تسعينيات القرن العشرين. وفي كثير من الحالات، كان الباحثون يعدلون البروتينات الموجودة أصلاً. ومع ذلك، فإن نطاق البروتينات الطبيعية محدود. ولزيادة إمكانية الحصول على بروتينات ذات وظائف جديدة تماما، أرادت مجموعة بيكر البحثية إنشاءها من الصفر.
إن المجال الذي يتم فيه بناء بروتينات جديدة بالكامل يسمى تصميم دي نوفو (de novo design). حيث قامت مجموعة البحث برسم بروتين ببنية جديدة تمامًا، ثم طلبت من روزيتا حساب نوع تسلسل الأحماض الأمينية الذي قد ينتج عنه البروتين المطلوب. للقيام بذلك، بحثت روزيتا في قاعدة بيانات تحتوي على جميع هياكل البروتين المعروفة، وبحثت عن أجزاء قصيرة من البروتينات التي لها أوجه تشابه مع البنية المطلوبة. باستخدام المعرفة الأساسية بطاقة البروتينات (proteins’ energy landscape)، قامت روزيتا بعد ذلك بتحسين هذه الأجزاء واقترحت تسلسلًا للأحماض الأمينية.
للتحقق من مدى نجاح البرنامج، وضعت مجموعة بحث بيكر الجين لتسلسل الأحماض الأمينية المقترح في البكتيريا التي تنتج البروتين المطلوب. ثم حددوا بنية البروتين باستخدام دراسة البلورات بالأشعة السينية. اتضح أن روزيتا يمكنها حقًا بناء البروتينات. كان البروتين الذي طوره الباحثون، (Top7)، له البنية التي صمموها تقريبًا.
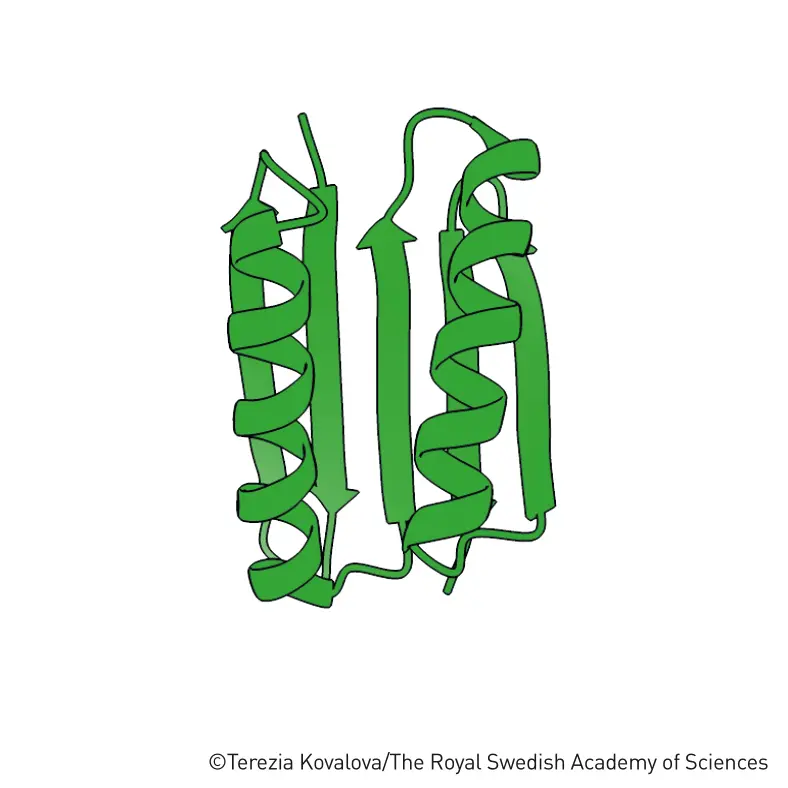
البروتين Top7
كان (Top7) بمثابة صاعقة من السماء للباحثين الذين يعملون على تصميم البروتينات. أولئك الذين سبق لهم إنشاء بروتينات جديدة لم يتمكنوا إلا من تقليد الهياكل الموجودة في الطبيعة. ولم يكن الهيكل الفريد لـ (Top7) موجودًا في الطبيعة. بالإضافة إلى ذلك، مع أحماضه الأمينية الـ 93، كان هذا البروتين أكبر من أي شيء تم إنتاجه سابقًا باستخدام التصميم الجديد.
نشر بيكر اكتشافه في عام 2003. كانت هذه الخطوة الأولى في شيء لا يمكن وصفه إلا بأنه تطور غير عادي. كما أصدر كود روزيتا، لذلك استمر مجتمع البحث العالمي في تطوير البرنامج، وإيجاد مجالات جديدة للتطبيق.
بعد مسابقة (CASP) لعام 2020، عندما أدرك ديفيد بيكر إمكانات نماذج الذكاء الاصطناعي القائمة على المحولات، قام بإضافتها إلى روزيتا، مما سهّل أيضًا التصميم الجديد للبروتينات. وفي السنوات الأخيرة، ظهرت عملية إنشاء بروتين مذهلة تلو الأخرى من مختبر بيكر.
تطبيقات متعددة
هذا الاكتشاف لديه القدرة على إحداث ثورة في مجالات مثل الطب والتكنولوجيا الحيوية وعلوم المواد. سيكون تأثير هذا الاكتشاف محسوسًا إلى ما هو أبعد من المجتمع العلمي. حيث سيحسن حياة الملايين من الناس في جميع أنحاء العالم، من توفير أدوات جديدة لمتخصصي الرعاية الصحية إلى إيجاد حلول مستدامة للبيئة.
وفي المستقبل القريب، يمكننا أن نتوقع أن نرى طفرة في التطبيقات المبتكرة لهذه التكنولوجيا. حيث سيتمكن الباحثون من استخدام ألفافولد 2 لدراسة بنية البروتينات المرتبطة بأمراض مختلفة، مما يؤدي إلى فهم أعمق للأسباب الكامنة وربما يمهد الطريق لعلاجات جديدة.
علاوة على ذلك، فإن تصميم البروتينات الجديدة لديفيد بيكر سيمكننا من خلق إنزيمات جديدة قادرة على تحليل النفايات البلاستيكية، والحد من انبعاثات الغازات الدفيئة، وتطوير ممارسات زراعية مستدامة. ومع استمرار ظهور إمكانيات هذا الاكتشاف، يمكننا أن نتوقع رؤية تأثير تحويلي على المجتمع ككل.
لعبة بناء البروتين
صمم فريق الأكاديمية بوست لعبة صغيرة لشرح عملية بناء البروتين لغير المتخصصين، يمكنك لعبها من هنا ومشاركتها مع الأطفال والكبار. استمتع باللعبة من هنا:
المصدر
The Nobel Prize in Chemistry 2024 | nobel prize
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.



التعليقات :