يعد التشخيص والكشف المبكر عن الأمراض واحد من أهم تطبيقات طب النانو. كما يعتبر الكشف المبكر عن المرض وتشخيصه عاملًا مهماً في الشفاء خاصةً بالنسبة لمرضى السرطان.
فعلى سبيل المثال، لوحظ في دراسة دامت عامين أن معدل البقاء على قيد الحياة لمرضى سرطان الجهاز الهضمي الذين استفادوا من الكشف المبكر أعلى بكثير من أولئك الذين لم تكشف إصاباتهم مبكرًا بنسب بلغت 92.3% مقابل 33.3% [4]. بالإضافة إلى أن معدل الوفيات المدروس لمدة 10 سنوات لمرضى سرطان الثدي انخفض بنسبة 17-28% لدى المرضى الذين استفادوا من الكشف والتشخيص المبكر [2].
وغالبًا ما تلعب تقنية التصوير الطبي الدور الأكثر أهمية في الكشف والتشخيص المبكر عن لأمراض المختلفة. ويتم حاليًا العمل على تكييف أساليب التصوير الطبي المختلفة بحيث تعمل ضمن المقاييس النانوية وذلك بتحسين قدرتها على تتبع الجسيمات النانوية المحقونة ضمن الجسم والمستخدمة كعوامل تباين نانوية. إذ يوفر التصوير الطبي بالمقاييس النانوية صور أكثر تفصيلاً للعمليات الخلوية مما يتيح إمكانية التشخيص المبكر بفعالية أكبر [1].
محتويات المقال :
عوامل التباين في التصوير الطبي
وفقاَ لما تَقَدم فإن الحاجة الملحة للكشف المبكر عن الأمراض وتشخيصها تدفع باستمرار لتطوير طرق التصوير الطبي المختلفة وبالأخص تطوير عوامل التباين. ويمكن تعريف عوامل التباين بأنها مواد تستخدم للحصول على معلومات تشريحية ووظيفية أكثر دقة في التصوير الطبي للتمييز بين الأنسجة الطبيعية والأنسجة غير الطبيعية [2].
مواد التباين المستخدمة حاليا لها استقلاب ودوران سريع داخل الجسم، ولها توزع غير محدد وسمية محتملة. لذا لا تزال التحديات الحالية قائمة للحصول على تصوير طبي سريع وأكثر تفصيلًا للبنى المجهرية للأنسجة. ويتم ذلك من خلال تطوير عوامل تباين غير سامة ولها وقت دوران أكبر داخل الجسم [2].
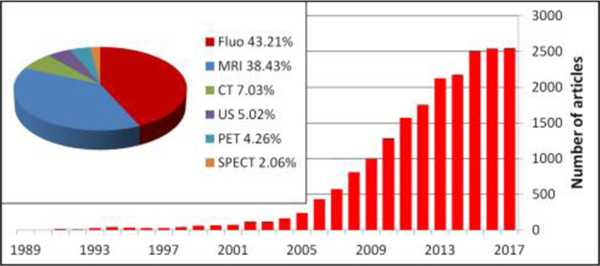
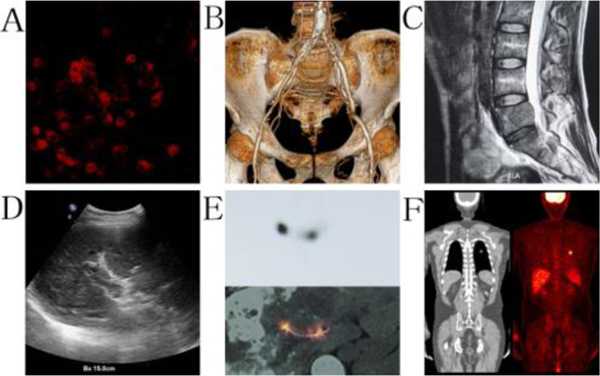
تتيح الجسيمات النانوية هذه القدرة، إذ تعود عوامل التباين القائمة على الجسيمات النانوية بفائدة كبيرة على العمليات السريرية، فنظرًا لصغر حجمها تُظهر الجسيمات النانوية تأثيرات نفاذية وبقاء معززة في الأورام. وتستخدم مع العديد من تقنيات التصوير الطبي مثل (التصوير الفلوري، والتصوير بالرنين المغناطيسي، والتصوير المقطعي المحوسب، والتصوير بالأمواج فوق الصوتية،PET، SPECT) [2].
إحصائيات عن تقنية النانو في التصوير الطبي
بالنظر إلى حدود عوامل التباين الحالية، والمزايا المحتملة للجسيمات النانوية كعوامل تباين للتشخيص المبكر وتصوير البنية المجهرية، نلاحظ تزايد الاهتمام بتكنولوجيا النانو في التصوير الطبي الحيوي بسرعة كبيرة، إذ يُظهر البحث عن مصطلح “الجسيمات النانوية والتصوير الطبي” في PubMed زيادة ملحوظة مؤخرًا في عدد المنشورات ذات الصلة مما يبرز الجهود المكثفة المبذولة في هذا المجال.
اعتبارات تصميم عوامل التباين القائمة على الجسيمات النانوية
- اختيار الجسيمات النانوية: تم اقتراح مجموعة واسعة من الجسيمات النانوية لاستخدامها كعوامل تباين، وتتطلب طرق التصوير المختلفة جسيمات نانوية ذات خصائص مختلفة لإنتاج التباين [3].
- أنواع الطلاء: الكثير من المواد النشطة وظيفيًا والمستخدمة لتوليد التباين في التصوير الجزيئي لها توافق حيوي منخفض جدًا مما يؤدي إلى إفراز سريع خارج الجسم وعمر نصف منخفض واستقرار منخفض وسمية محتملة. لذلك تم بذل جهود كبيرة لجعل هذه المواد قابلة للتطبيق بيولوجيًا. وتم اكتشاف مجموعة متنوعة من الأساليب المختلفة باستخدام مواد مثل الفوسفوليبيدات وديكستران وبولي فينيل بيروليدون أو السيليكا كطلاء. وتتمثل الاستراتيجية البديلة للطلاء الاصطناعي في استخدام الجسيمات النانوية الطبيعية مثل الفيروسات أو البروتينات الدهنية وبالتالي تجنب تعرف أنظمة الدفاع في الجسم عليها [3].
- استراتيجيات استهداف الخلايا والمناطق الهدف: إما الاستراتيجية الفعالة أو السلبية، وتحدد الأولى بربط الجسيمات النانوية بأنواع مختلفة من الجزيئات كالـ(البروتينات والببتيدات وغيرها). في حين تحدد الثانية من خلال الطلائات كال( ديكستران ) مثلا [3].
- تأثير الحجم: يلعب حجم الجسيمات النانوية دورًا مهمًا في عدد من الجوانب بما في ذلك أنواع الخلايا التي يمكن استهدافها ونفاذيتها ضمن الأنسجة واستقلابها في الجسم وقوة وجودة التباين الناتج [3].
فمثلا، حجم الجسيمات النانوية مهم في إفراز الجسيمات من الجسم. حيث يتم إزالة الجسيمات النانوية من الجسم عبر الجهاز الكلوي [3]. و باستخدام تقنيات التألق تبين أن الجسيمات النانوية التي تساوي أو تقل عن 5.5 نانومتر يتم إفرازها من خلال الجهاز الكلوي في حين أن الجسيمات الأكبر من ذلك ينتهي بها الأمر في الكبد والطحال. هنا يتم استقلابها وإفرازها أو تتراكم وقد تصبح سامة للجسم. من ناحية أخرى إذا كانت الجسيمات صغيرة بما يكفي لإفرازها كلويًا فسيقل نصف عمرها [3].
استخدام الجسيمات النانوية في التصوير الفلوري
يتمتع التصوير الفلوري بمزايا تغلغل أكبر ضمن الأنسجة، وتألق أقل للأنسجة غير المرغوبة [2]. ولكن يعيبه عمق اختراقه المحدود وتعيق عملية التشتت ضمن النُسج المختلفة النفع المحتمل من المعلومات السريرية التي يقدمها. وكما يؤدي التألق المحدود في المرض المستهدف والتبييض الضوئي لحساسية منخفضة للكشف عن الأمراض الشاذة [2].
وهنا يأتي دور الجسيمات النانوية التي تتميز بخصائص مفيدة للتغلب على القيود المحتملة للتصوير الفلوري. فعلى سبيل المثال يمكن تحميل عدد أكبر من جزيئات الصبغة الفلورية في الجسيمات النانوية لتوفير المزيد من الإشارات. بالإضافة إلى ذلك يمكن تعديل (أو هيكلة) الجسيمات النانوية من أجل منع الإخماد المحتمل عند الحاجة. علاوة على ذلك يمكن استخدام بعض الاستراتيجيات لزيادة تركيزات الجسيمات النانوية في الأمراض ومن ثم زيادة تركيز الصبغة الفلورية للمشكلة المحلية. كما تتميز الجسيمات النانوية بقضائها وقتًا طويلًا نسبياً في الدورة الدموية، مما يعطي امتصاصاً أكبر للأمراض المستهدفة. ويمكن أيضاً تصميم الجسيمات النانوية لتحويل فوتونات الطاقة المنخفضة إلى فوتونات ذات طاقة أعلى وهو أمر مهم لتقليل تأثيرات الوميض والتبييض الضوئي [2].
وقد تم استخدام الجسيمات النانوية كعوامل تباين في التصوير الفلوري في الكثير من الموضوعات. مثل الكشف عن الجينات، وتحليل البروتين، وتقييم نشاط الإنزيم، وتتبع العناصر، وتتبع الخلايا، وتشخيص الأمراض في مرحلة مبكرة، والبحوث المتعلقة بالأورام، ومراقبة التأثيرات العلاجية في الوقت الحقيقي [2].
أمثلة من مجموعة دراسات لخصها المرجع [2] في الجدول 1 لاستخدام الجسيمات النانوية في التصوير الفلوري، وتتضمن اسم عامل التباين في التصوير، وحجم الجسيمات النانوية، والتطبيقات الطبية الحيوية، وما إذا كان قد تم التجريب في الجسم الحي أو في المختبر [2].
| Experimental model | Applications | Size (nm) | Imaging agent |
| SK-BR-3 human cancer cells, CHO-K1 Chinese hamster ovary cells | Detecting early stage breast cancer | 120 | UCNP |
| Mice bearing SCC7 tumors | Detecting protease activity | 20 | Cy5.5 |
| HeLa cells | Testing caspase-3 to identify apoptosis activity in cells | 37.8 | Cy5.5 |
| SCC-7 cells, 293T cells and athymic BALB/c nude mice bearing SCC-7 cells | Detecting tumor and guiding therapy | 141 | PLNP |
| HepG2 cells | Tracking ion of Zn and Cu in alive cell | 13 | FAM,Cy5 |
| A549 lung cancer cells | Monitoring therapeutic drug delivery | 90.9 | FITC |
| Athymic nude mice | Monitoring drug diffusion | 30 ,200 | Cy7.5 |
| Swiss nude mice bearing HCT-116 cells | Monitoring NP accumulation and dissociation kinetics in tumor | 20 | Cy7 |
| BALB/c mice, athymic nude mice bearing SKOV3 tumors | Targeted imaging tumor cells | 12 | Quantum dots |
| Breast cancer cells (MCF-7) | Detecting MCF-7 cell in breast cancer | 120 | PFVBT |
| Breast cancer cells (MCF-7) | Imaging double-stranded DNA | 3.6 | Ethidium bromide |
| HeLa cells | Detecting nanotoxicity in alive cells | 18, 70 | Perylenediimide |
| TT cells (human thyroid cancer cells), athymic nude mice bearing TT cells | Monitoring cellular uptake of nanoparticles and combined with therapy | 14 | UCNP |
| Nude mice | Detecting lymph node | 55 | IR |
استخدام الجسيمات النانوية في التصوير بالرنين المغناطيسي MRI
التصوير بالرنين المغناطيسي MRI هو طريقة تصوير قوية تستخدم منذ فترة طويلة في التشخيص السريري. يعتمد على دوران البروتون عند وجود مجال مغناطيسي خارجي، حيث تتم إثارته بنبض ذو تردد راديوي. اعتمادًا على إشارة الرنين المغناطيسي النووي الصادرة عن البروتونات في الأجسام البشرية يوفر التصوير بالرنين المغناطيسي دقة مكانية عالية ودقة زمنية وتباينًا ممتازاً للأنسجة الرخوة. كما أن لديه القدرة على إظهار المعلومات التشريحية المقطعية في شكل ثلاثي الأبعاد. تشمل حدود التصوير بالرنين المغناطيسي التكلفة وأوقات التصوير الطويلة نسبياً وحدود الأجهزة والأعضاء المزروعة المحتمل وجودها لدى المرضى. تساعد عوامل التباين في التصوير بالرنين المغناطيسي بشكل كبير في اكتشاف الآفات والتمايز عن الأنسجة السليمة [2].
يمكن لعوامل التباين الجديدة بمقياس نانو متر أن تتيح استخدام التصوير بالرنين المغناطيسي على مستويات الجينات والبروتين والخلية والأعضاء كما تعتمد التطبيقات الأخرى على الامتصاص الخلوي غير المحدد مثل تصوير الالتهاب وتحديد العقدة الليمفاوية الخبيثة وتتبع الخلايا الجذعية ومراقبة الغرسات الحيوية [2].
تم تلخيص أمثلة عن التصوير بالرنين المغناطيسي مع استخدام عوامل تباين نانوية بواسطة المرجع [2] أيضا في الجدول 2 بما في ذلك تكوين الجسيمات النانوية وطرق التصوير وحجم الجسيمات النانوية والتطبيقات الطبية الحيوية وما إذا كان قد تم تجريبه في الجسم الحي أو في المختبر.
| Experiment model | Imaging | Applications | size (nm) | NP |
| VX-2 rabbit | T1 | Imaging angiogenesis | 273 | Alpha(nu)beta(3)-Gd (paramagnetic particle) |
| SD rats | T1 | Imaging placenta as blood-pool contrast | 125 | Liposomal gadolinium |
| NIH/3T3 and T6–17 cells | T2 | Imaging target cells | 74 | Her2/neu-Oleosin-30G (Micelles) |
| RAW264.7 cells, BALB/c mice | T1,T2 | New T1/T2 MRI contrast agent | 50.4 | G4.5-Gd2O3-PEG |
| GFP-R3230Ac cell line | T2 | Tracking GFP gene marker | 70-140 | SPIO |
| ApoE-/- mice | T1 | Imaging and characterizing atherosclerotic plaques | 14-17 | rHDL-Gd |
| Mouse | T1,T2 | Blood-pool contrast with longer life-time | 60 | RBC encapsulated iron particles |
| HeLa cells | T2 | Determining nanoparticle vehicle unpackaging for gene | 100 | USPIO-PEI |
| Mice bearing C26 and HT-29 cells | T1,T2 | PH-activatable contrast in cancer | 60 | PEGMnCaP NPs |
| BALB/c nude mice | T1,T2 | Imaging lymph node | 100 | Mn-nanotexaphyrin |
| Rabbit | T2 | Delivering drug and MRI imaging | 15-300 | Micelles with PTX and SPIO |
| Porcine vascular smooth muscle cells | T1 | Evaluating and quantifying drug delivery system for vascular restenosis | 250 | TF-biotinylated perfluocarbon-(Gd-DTPA-BOA)@(doxorubicin /paclitaxel) |
| Mouse | T2 | Detecting and imaging thrombus | 40 | FibPep-ION-Micelles |
| C57BL/ 6 mice | T2 | Imaging post-stroke neuroinflammation | 50 | P-selectin-MNP(iron oxide)-PBP |
| In vivo | T2 | High power liver imaging contrast | 80 | Mn-SPIO micella |
| BALB/c nude mice | T1,T2 | Imaging pancreatic islet graft | 44 | TMADM-03 |
| Swiss mice | T2 | Imaging and tracking stem cells | 88.2 | DHCA functioned IONP labeled hMSCs |
| LNCaP and PC3 cell line | T1,T2 | Imaging prostate cancer cells and chemotherapy | 66.4 | TCL-SPION-Apt |
| Mice bearing MDA-MB-468 cells | F-MRI | Detecting breast cancer | 7.8 | HBPFPE-aptamer |
استخدام الجسيمات النانوية في التصوير المقطعي المحوسب CT
يستفيد التصوير المقطعي المحوسب (CT) من توهين الأشعة السينية في الأنسجة لإنشاء صور مقطعية وثلاثية الأبعاد. نتيجة لسرعة الفحص وانخفاض التكلفة، وتحسين الكفاءة، وزيادة الدقة المكانية للتصوير السريري، سرعان ما حل التصوير المقطعي محل التصوير الشعاعي للفيلم العادي رغم الكميات الأكبر من التعرض للإشعاع المؤين [2].
تلعب عوامل التباين المقطعي المحوسب دورًا مهمًا في التمييز بين الأنسجة ذات معاملات التوهين المماثلة. حاليًا تعتمد عوامل التباين المقطعية المحوسبة في الوريد أساسًا على اليود. تشمل حدود عوامل التباين الميودنة الإزالة السريعة من الجسم والتسمم الكلوي المحتمل والتوزيع غير النوعي في الدم والأحداث الضارة الموثقة والحساسية المفرطة. نتيجة لذلك تم إدخال عوامل التباين النانوية للتغلب على هذه القيود وزيادة نطاق التصوير المقطعي المحوسب [2].
تم استخدام عوامل التباين النانوية في التصوير المقطعي المحوسب في أدوار متعددة بناءً على امتصاصها الخلوي، والقدرة على توليد توهين قوي للتصوير المقطعي المحوسب، وقدرات الاستهداف الخاصة بها. على سبيل المثال، تم استخدام جزيئات الذهب النانوية التي تبتلعها خلايا الدم الحمراء لتصوير تدفق الدم. اليود الشحمي مع وقت دوران طويل وتقوية التصوير المقطعي المحوسب قد تم استخدامه لتقييم الأوعية الورمية وتم استخدامه لتصوير سرطان البروستاتا. وأخيراً تم استخدام تراكم الجسيمات النانوية لثاني أكسيد الزركونيوم لتصوير الورم ومراقبة توزيع الأدوية [2].
يوضح الجدول 3 من المرجع [2] أمثلة عن التصوير المقطعي المحوسب مع استخدام عوامل تباين نانوية ويعرض تكوين الجسيمات النانوية وحجم الجسيمات النانوية والتطبيقات الطبية الحيوية وما إذا كان قد تم تجريبه في الجسم الحي أو في المختبر.
| Experiment model | Applications | Size (nm) | NP |
| LNCaP and PC3 prostate cancer cells | Imaging prostate cancer cells | 29.4 | PSMA-specific aptamer conjugated AuNP |
| Apolipoprotein E-deficient mice | Imaging macrophage-rich atherosclerotic plaques | 400 | Liposomal iodine |
| Balb/c mice bearing 4T1/Luc cells | Identifying tumor vascular structure | 100 | Liposomal-iodine |
| In vitro | Producing greater imaging capability than iodine | <6 | Tantalum oxide |
| In vitro | Incorporating RBC to image blood flow | 20 | AuNP |
| Mice bearing EMT-6 and CT-26 cells | Labelling tumor cells to image tumor growth | 1 | AuNP |
| B6C3f1 mice bearing Tu-2449 cells | Imaging brain malignant gliomas and enhancing radiotherapy | 11 | AuNP |
| Mice | AuNP with CT contrast capability | 27-176 | AuNP |
| Rat bearing R3230 AC cells | Imaging tumor | 113 | Liposomal iodine |
| FSL rat | Tracking mesenchymal stem cells | 20 | AuNP |
استخدام الجسيمات النانوية في التصوير بالأمواج فوق الصوتية US
التصوير بالموجات فوق الصوتية US هو أحد أكثر طرق التصوير التشخيصي الطبي استخدامًا نظرًا لقابليته للنقل وعدم التوغل في الجسم والدقة المكانية العالية والتكلفة المنخفضة وخصائص التصوير في الوقت الفعلي. تم تطوير عوامل التباين المستخدمة في الموجات فوق الصوتية لتعزيز اختلاف الإشارات الصوتية بين الأنسجة السليمة والآفات المستهدفة. تتكون عوامل التباين بالموجات فوق الصوتية المتوفرة تجارياً من فقاعات صغيرة تتراوح في مقياس من 1 إلى 8 مايكرومتر. وقد تم استخدام تقنية النانو للتغلب على القيود المحتملة لعوامل التباين الحالية، فالجسيمات النانوية كعوامل تباين بالتصوير في الموجات فوق الصوتية أصغر بكثير من عوامل التباين بالموجات فوق الصوتية المستخدمة حالياً. فكما هو الحال مع الجسيمات النانوية الأخرى فإن الحجم الصغير يسهل استهداف الآفات، وتشمل التطبيقات تصوير الخلايا الجذعية واكتشاف الالتهاب وتوصيل الأدوية. ومع ذلك من أجل الحصول على ما يكفي من الانعكاس الصوتي تحتاج الجسيمات النانوية في الأمواج فوق الصوتية عادة إلى أن تكون أكبر من الجسيمات النانوية منها في CT أو MRI والتي تتراوح من مئات إلى آلاف النانومتر [2].
تم تلخيص أمثلة على عوامل التباين بالموجات فوق الصوتية للجسيمات النانوية في الجدول 4 حيث ذكر تكوين الجسيمات النانوية وتصنيفها وحجم الجسيمات النانوية والتطبيقات الطبية الحيوية وما إذا كان قد تم تجريبه في الجسم الحي أو مختبر [2].
| Experiment model | Classification | Applications | Size (nm) | NP |
| Bel7402 and L02 cells | Liquid | Molecular tumor imaging agents | 229.5 | FA-PEG-CS and perfluorooctyl bromide nanocore |
| In vitro | Gas | Ultrasound imaging agents with potential therapeutic applications | 3000 | Silica coated NP into perfluorobutane microbubble |
| Wister rat | Gas | Ultrasound imaging agents | 152 | C3F8-filled PLGA |
| Label human mesenchymal stem cells and inject into nude mice | Solid | Stem cell imaging agent | 30-150 | Exosome-like silica NP |
| Rabbit vx2 tumor | Solid | Ultrasound imaging agents | 260 | Rattle-type MSN |
| C3H/HeN mice bearing SCC-7 cells | Gas | PH related contrast agents in tumor | 290 | Gas-NP |
| SKBR-3 and MDA-MB-231 human breast cancer cells | Solid | Specific detection of tumor molecular marker | 250 | PLA-herceptin |
| Athymic mice bearing N2a cells | Gas | PH related contrast agents in tumor | 220 | RVG-GNPs |
| Chicken embro HT1080-GFP and Hep3-GFP tumor | Gas | Tumor imaging contrast agent | 185 | Porphyrin nanodroplet |
| CD1 mice | Gas | Ultrasound imaging agents | 100-200 | PFC-NP(C4F10) |
استخدام الجسيمات النانوية PET\SPECT
التصوير المقطعي بالإصدار البوزيتروني (PET) هو تقنية طب نووي قوية ومستخدمة على نطاق واسع مع اختراق عالي للأنسجة وحساسية عالية وتصوير في الوقت الحقيقي. إلى جانب المعلومات التشريحية قد توفر PET أيضًا معلومات بيولوجية على المستوى الجزيئي بناءً على تتبع النويدات [2].
التصوير المقطعي المحوسب بانبعاث فوتون واحد (SPECT) هو تقنية أخرى للطب النووي مستخدمة على نطاق واسع ولها مزايا مماثلة مثل التصوير المقطعي بالإصدار البوزيتروني حيث يمكنها اكتشاف الوظيفة كيميائية حيوية غير الطبيعية قبل حصول التغييرات في علم التشريح [2].
تشمل قيود PET / SPECT التكلفة العالية والتعرض الإشعاعي العالي [2].
تُستخدم الجسيمات النانوية في PET / SPECT بشكل أساسي في الكشف عن الأورام [2].
تم تلخيص أمثلة عن الجسيمات النانوية المستخدمة في التصوير PET\SPECT في الجدول 5 بما في ذلك تكوين الجسيمات النانوية والحجم والتطبيقات الطبية الحيوية وما إذا كان قد تم اختباره في الجسم الحي أو في المختبر [2].
| Imaging modality | Experiment model | Applications | Size (nm) | NP |
| PET | Mice bearing U87MG tumor | Imaging tumor | 100-150 | F-labeled DBCO-PEGylated MSN |
| PET | Mice | Detecting pulmonary inflammation | 200 | I-labeled anti-ICAM-1/PVPh-NP |
| PET | Mice bearing neuro2A tumor | Monitoring pharmacokinetics and tumor dynamics | 37 | Cu labeled IT-101 |
| PET | Athymic mice bearing CWR22 tumor cells | Imaging natriuretic peptide clearance receptor in prostate cancer | 16-22 | Cu labeled CANF-comb nanoparticle |
| PET | C57BL/6 mice deficient in apolipoprotein E | Imaging macrophages in inflammatory atherosclerosis | 20 | Cu-TNP |
| PET | C57BL/6 recipients of BALB/c allografts in mice | Detecting rejection and immunomodulation in cardiac allografts | 20 | Cu labeled CLIO-VT680 |
| PET | C57BL/6 mice deficient in apolipoprotein E | Imaging atherosclerosis in artery | 16-22 | Cu labeled CANF-comb nanoparticle |
| SPECT | BALB/C mice | Monitoring distribution of nanoparticles | 12 | I silver nanoparticle |
| SPECT | U87MG, MCF7 cells and nude mice bearing U87MG cells | Detecting cancer cells and imaging tumor sites | 31 | I labeled cRGD-PEG-AuNP |
| SPECT | C57BL/6 mice, nude mice and BALB/c mice bearing 4T1-Luc2-GFP cells | Imaging lymph node metastasis | 25 | In labeled lipid/calcium/phosphate NPs |
| SPECT | Nude mice bearing U87MG cells | Tracking glioblastoma | 70 | In-MSN labeled neural stem cells |
| SPECT | 4T1 TNBC mouse | Targeted imaging tumor | 5 | AuNPs(DAPTA) |
حاضر ومستقبل تقنية النانو في التصوير الطبي
نستنتج مما تقدم أنه وبالمقارنة مع عوامل التباين التقليدية، أظهرت الجسيمات النانوية المستخدمة كعوامل تباين تحسناً في كثافة الإشارة وقدرة الاستهداف ووقت دوران أطول في الجسم الحي في كل من نماذج الأمراض المختبرية والحيوانية خاصة لتشخيص السرطان وعلاجه. فبمساعدة تقنية النانو أصبحت طرق التصوير الطبي المعروفة أكثر قوة من ذي قبل. وأظهرت تحسنًا واعداً، إذ تقدم تقنية النانو الجسيمات النانوية التي تَعدنا بإمكانيات ثورية لاستخدامها كعوامل تباين في التصوير الطبي لمجموعة متنوعة من التطبيقات السريرية. كما تحسن تصميم هذه الجسيمات بشكل كبير خلال العقد الماضي، مع تعدد الوظائف والاستهداف الأكثر كفاءة والتوافق الحيوي الأفضل، والعوامل المناسبة لكل طريقة تصوير متاحة.
في المرحلة الحالية من التطوير بشكل عام يمكن تصنيع عوامل التباين النانوية التي تمتلك السمات المطلوبة لأي تطبيق مرغوب. حيث يتطلب تصميم عوامل تباين الجسيمات النانوية الفعالة للتصوير دراسة متأنية للخصائص المطلوبة للتطبيق المعني. وبمجرد تحديد الخصائص المطلوبة يمكن تحديد الجسيمات النانوية المرشحة. ويمكن بعد ذلك تحسين تخليق الجسيمات لإنشاء جسيمات تجمع التباين مع العلاجات المضمنة المناسبة وطلاء السطح الأمثل وخصائص الاستهداف والحجم المحدد ودرجة عالية من التوافق الحيوي.
ومع ذلك، ما زال هناك مجال لتحسينات كبيرة في التوافق الحيوي والفعالية والخصوصية واكتشاف المزيد من الأمراض باكرًا. وأخيراً ستستمر تقنية النانو في إنتاج جسيمات جديدة تمتلك خصائص جديدة ومثيرة للاهتمام وسيتم استغلالها في التصوير الطبي. كما سيستمر تطوير طرق التصوير الطبي مما يتطلب تركيب جسيمات نانوية جديدة كعوامل تباين.
المصادر
[1]. AZONANO
[2]. NCBI
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.





التعليقات :