محتويات المقال :
تكيف الخلايا مع الأكسجين يفوز بـ جائزة نوبل الطب 2019
بفضل العمل الرائد لهؤلاء الحائزين على جائزة نوبل، تعرفت البشرية على كيفية تنظيم مستويات الأكسجين المختلفة للعمليات الفسيولوجية الأساسية، فاستحق تكيف الخلايا مع الأكسجين أن يفوز بـ جائزة نوبل الطب 2019، ولكن ماذا حدث بالضبط؟ وما دور هؤلاء العلماء في الاكتشاف في نوبل الطب 2019 ؟ وما أهميته حقًا؟ سنتعرف في هذا المقال على آلية تكيف الخلايا مع تغير مستويات الأكسجين ونجيب على كل ما سبق من أسئلة تدور في بال متابعينا.
جائزة نوبل الطب 2019:
جاءت الاكتشافات الجوهرية التي قام بها الحاصلون على جائزة نوبل لعام 2019 عن واحدة من أهم آليات العمليات الأساسية في الحياة، فقد وضعوا حجر الأساس لفهمنا لكيفية تأثير مستويات الأكسجين على عملية الأيض الخلوية والوظيفة الفسيولوجية. أيضًا مهدت اكتشافاتهم الطريق لاستراتيجيات جديدة واعدة لمكافحة العديد من الأمراض مثل فقر الدم والسرطان وغيرهم.
تبدأ قصة هذا الاكتشاف بالعنصر الهام والمعروف والأساسي للحياة على الأرض، وهو الأكسجين. يشكل الأكسجين O2، حوالي خمس الغلاف الجوي للأرض، وهو ضروري للحياة؛ إذ يتم استخدامه بواسطة الميتوكوندريا الموجودة في جميع الخلايا الحية تقريبًا من أجل تحويل الغذاء إلى طاقة مفيدة. كل هذا معروف لكل طالب في المرحلة الابتدائية. إذن فما الجديد؟ وما الذي يستدعي منح جائزة كنوبل لهؤلاء العلماء؟

قصة تكيف الخلايا مع الأكسجين و جائزة نوبل الطب 2019 تبدأ من 1931:
للقصة بداية قديمة، إذ كشف الباحث “أوتو واربرج”، الحائز على جائزة نوبل في علم وظائف الأعضاء أو الطب عام 1931، أن هذا التحويل (يقصد به تحويل الغذاء إلى طاقة مفيدة) هو عبارة عن عملية إنزيمية، ولاحقًا تم الكشف عن آليات تضمن توفير كمية كافية من الأكسجين للأنسجة والخلايا.
الاستجابة الفسيولوجية الأساسية لنقص الأكسجة تتمثل في ارتفاع مستويات هرمون EPO «الإريثروبويتين-Erythropoietin»، مما يؤدي إلى زيادة إنتاج خلايا الدم الحمراء (الكريات الحمر). من هنا، ظهرت أهمية السيطرة الهرمونية على الكريات الحمر والتي عُرفت بالفعل في بداية القرن العشرين، ولكن بقاء هذه العملية نفسها تحت سيطرة الأكسجين بقيت لغزًا سنكشفه لك عبر مقالنا.
كيف يتم تنظيم جين EPO؟
باستخدام الفئران المعدلة وراثيًا، عرض «جريج سيمينزا-Greg Semenza» قطع الـ DNA محددة تقع بجانب جين EPO تتجاوب مع نقص الأكسجين، فدرس «بيتر راتكليف» أيضًا التنظيم المعتمد على الأكسجين لجين EPO، ووجدت كلتا المجموعتين البحثيتين أن آلية استشعار الأكسجين كانت موجودة في جميع الأنسجة تقريبًا، وليس فقط في خلايا الكلى التي يتم فيها إنتاج EPO بشكل طبيعي. كانت هذه نتائج مهمة وتُبين أن الآلية كانت عامة ووظيفية في العديد من أنواع الخلايا المختلفة.
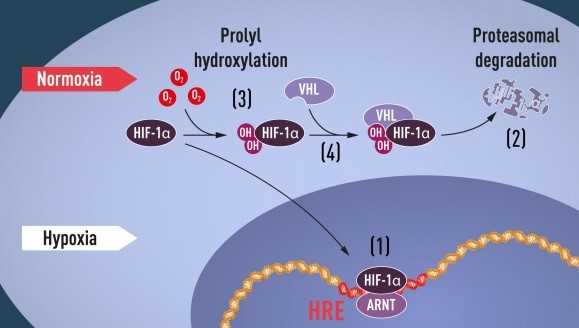
في خلايا الكبد المزروعة، اكتشف العالم سيمنزا مركب هام وهو مركّب بروتيني يرتبط بجزئ الحمض النووي بطريقة تعتمد على الأكسجين، ودعي هذا المركب باسم الـ(HIF) أو «العوامل المحفّزة لنقص الأكسجين-Hypoxia-inducible factors».
كيف مهدت أعمال العالم سيمينزا الطريق؟
بدأ سيمينزا جهود مكثفة في تنقية مُركّب الـ HIF لمعرفة ماهيته، وفي عام 1995، تمكن من نشر بعض النتائج الرئيسية، بما في ذلك تحديد الجينات التي ترمز بروتين الـ HIF. وتم معرفة مكونات بروتين الـ HIF بنجاح، فعرفنا أنه يتكون من بروتينين مختلفين مرتبطين بالحمض النووي، تمت تسميتهم بعوامل النسخ (HIF-1α و ARNT).
أمكن للباحثين حينئذ البدء في حل اللغز، فقد فتحت أعمال سيمنزا الباب لفهم المكونات الإضافية المشاركة، وكيف تعمل الآلية. فقد لاحظ الباحثون أن ارتفاع مستويات الأكسجين، يصحبه نقص في محتويات الخلايا من الـ HIF-1α، وأن انخفاض مستويات الأكسجين، يصحبها ارتفاع في كمية الـ HIF-1α بحيث يمكن ربطهما سويًا بشكل عكسي، وبالتالي يمكن ربطهما بتنظيم جين الـ EPO والجينات الأخرى الملازمة لقطع المادة الوراثية الخاصة بالـ HIF. ثم أظهرت عدة مجموعات بحثية أن «HIF-1α» -والذي عادة ما يتحلل ويتكسّر بسرعة- محمي من التحلل والتكسير مع نقص الأكسجة، وهو أمر غريب!
إذن فكيف يتحلل بروتين الـ «HIF-1α» وتقل نسبته عند ارتفاع مستويات الأكسجين في الخلية؟
هنا قصة أخرى لا تقل في روعتها عن قصة سيمنزا وراتكليف، إذ اكتشف الثلاثي Aaron Ciechanover وAvram Hershko وIrwin Rose آلية تُعرف باسم ال Proteasome وحصلوا عن كشفهم هذا جائزة نوبل عام 2004 في الكيمياء، وتعمل تلك الآلية على تكسير بروتين الـ «HIF-1α»، عند مستويات الأكسجين الطبيعية والمرتفعة، إذ يتم إضافة ببتيد صغير يُدعى اليوبيكويتين، إلى بروتين HIF-1α، ويعمل اليوبيكويتين كعلامة وإشارة للبروتينات الموجهة لتكسير وتحليل بروتين الـ«HIF-1α». ولكن تظل كيفية ارتباط اليوبيكويتين بـ HIF-1α بطريقة تعتمد على الأكسجين مسألة مركزية وغامضة لكنها مؤكدة!
إذن، فما قصة الباحث ويليام كيلين؟ ولماذا حصل على نوبل معهم؟
في نفس الوقت الذي كان سيمينزا وراتكليف يكشفان عملية تنظيم جين الـ EPO، عكف باحث السرطان ويليام كيلين جونيور على كشف أسرار حالة وراثية غريبة، تُعرف باسم (VHL) «فون هيبل لينداو-Von Hippel Lindau»، وهي حالة مرضيّة تؤدي لزيادة كبيرة في خطر الإصابة ببعض أنواع السرطان في العائلات التي تحمل طفرات الـ VHL الموروثة.
هل هناك علاقة تربط بين VHL وHIF-α1؟
اكتشف كايلين أن جين VHL ينتج بروتينًا يمنع ظهور السرطان، ووجد أيضًا أن الخلايا السرطانية التي تفتقر إلى جين الـ VHL الوظيفي السليم، تعبر -بشكل غير طبيعي- عن مستويات عالية من الجينات المنظمة لنقص الأكسجة؛ ولكن عندما أعيد إدخال جين الـ VHL في الخلايا السرطانية، استعادت المستويات الطبيعية. كان هذا دليلًا مهمًا يوضح أن جين الـ VHL متورطًا بطريقة ما في التحكم في الاستجابة لنقص الأكسجة.
إذن فما دور العالم راتكليف؟
أظهرت أدلة إضافية من عدة مجموعات بحثية أن جين الـ VHL هو جزء من مجموعة معقّدة من البروتينات التي تعمل مثل اليوبيكويتين، فتكسر وتحلل الHIF-α1، إلى أن استفاد راتكليف من أعمال كايلين وقام هو ومجموعته البحثية بعد ذلك باكتشاف رئيسي يثبت أن VHL يمكن أن يتفاعل مع HIF-1α لتكسيره وتحليله في مستويات الأكسجين الطبيعية. وهو ما ربط بين الـ VHL وHIF-α1 بشكل قاطع. وبالرغم من كشف الكثير من قطع اللعبة، إلا أنه ما زال ينقصنا فهم كيفية تنظيم مستويات الأكسجين للتفاعل بين VHL و HIF-1α حتى ذلك الوقت!
ركز البحث على جزء معين من بروتين HIF-1α المعروف بأهميته في التحلل المعتمد على جين الـ VHL، وقد اشتبه كل من كايلين وراتكليف في أن مفتاح استشعار الأكسجين يتواجد في مكان ما في هذا البروتين.
هل تم حل اللغز؟
في عام 2001، نشر العالمين في وقت واحد بحثين علميين يقولان بأنه يتم إضافة مجموعات الهيدروكسيل في موقعين محددين في الـ HIF-1α في ظل مستويات الأكسجين الطبيعية. يسمح هذا التعديل للبروتين -والذي يسمى «prolyl hydroxylation»- للـ VHL بالتعرف على الـ HIF-1α والارتباط به، وهو ما كشف عن دور الهيدروكسيل في التحفيز الجيني لبروتين الـ HIF-1α وبالتالي تم تفسير كيفية تحكم مستويات الأكسجين الطبيعية في التحلل السريع لـ HIF-1α بمساعدة إنزيمات حساسة للأكسجين (البروليل هيدروكسيليز)، ليُحل اللغز!
ما أهمية الاكتشاف في حياتنا؟
إن جهاز المناعة لدينا يتم ضبطه هو والعديد من الوظائف الفسيولوجية الأخرى بواسطة استشعار خلايانا للأكسجين. فقد ثبت أن استشعار الأكسجين ضروري أثناء نمو الجنين للسيطرة على تكوين الأوعية الدموية الطبيعية وتطور المشيمة. وتشمل الأمثلة الأخرى للعمليات التكيفية التي يتحكم فيها استشعار الأكسجين في توليد أوعية دموية جديدة وإنتاج خلايا الدم الحمراء.
إن استشعار الأكسجين أمر أساسي لعدد كبير من الأمراض، على سبيل المثال، المرضى الذين يعانون من الفشل الكلوي المزمن غالبا ما يعانون من فقر الدم الحاد بسبب انخفاض تعبير الـ EPO، إذ ينتج الـ EPO بواسطة خلايا في الكلى وهو ضروري للسيطرة على تكوين خلايا الدم الحمراء.
هل للآليات المنظمة للأكسجين دور في السرطان؟
في الأورام، يتم استخدام الآلية المنظمة للأكسجين لتحفيز تكوين الأوعية الدموية وإعادة تشكيل الأيض من أجل الانتشار الفعال للخلايا السرطانية، وتركز الجهود المستمرة والمكثفة في المختبرات الأكاديمية وشركات الأدوية على تطوير عقاقير يمكنها أن تتداخل مع حالات مرضية مختلفة إما عن طريق تنشيط أو تثبيط آلية استشعار الأكسجين. من يعلم، فقد يحمل الكشف علاج نهائي لمرض طالما حلمنا بالقضاء عليه.
تقديم: آلاء السطام
مراجعة علمية: عبدالله طه
المصادر:
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear
factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl
Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a
basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci
USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E.,
Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor
protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399,
271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane,
W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline
hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim,
A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe,
P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-
regulated prolyl hydroxylation. Science, 292, 468-472
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.




التعليقات :