تطلق جميع المواد –بما في ذلك أجسادنا- بضع إشعاعات في كل فترة زمنية معينة بشكل تلقائي. وهذا ما يُعرف بالنشاط الإشعاعي. وما يميز أجسامنا عن الأجسام المصنعة في مفاعل نووي هو درجة هذا النشاط، أي عدد الإشعاعات التي يبعثها في الساعة.وتعتبر أجسادنا مستقرة إشعاعيًا، نظرًا للمقدار الضئيل الذي تبعثه من الإشعاعات. وفي المقابل، تعتبر مادة اليود المشع – التي تستعمل في علاج سرطان الغدة الدرقية- نشطة إشعاعيًا. فكيف تم اكتشاف النشاط الإشعاعي؟ وماهو القانون الذي يحكمه؟ ومتى يجب أن نقلق من وجود هذا النشاط بجوارنا؟
محتويات المقال :
اكتشاف النشاط الإشعاعي
كان اكتشاف النشاط الإشعاعي مصادفة نوعًا ما. حيث اكتشفه العالم الفرنسي «هنري بيكريل-Henri Becquerel» وهو يحاول معرفة مصدر الأشعة السينية. وقد قاده افتراضه أن مصدر هذه الأشعة هو إشعاعات الشمس إلى تعريض أحد أحجار اليورانيوم لأشعة الشمس، على أساس أن الحجر سيطلق بعدها حزمة من الأشعة السينية. نجحت التجربة ولاحظ هنري وجود آثار لإشعاعات منبعثة. وللتأكد أكثر من النتيجة، أعاد التجربة دون أن يُعرض الحجر لأشعة الشمس. فوجد أن الإشعاعات قد انبعثت مرة أخرى. وهذا يعني أن الحجر يبعث إشعاعات من تلقاء نفسه دون الحاجة إلى محفز. وكانت هذه هي ظاهرة النشاط الإشعاعي.
بعدها نجحت «ماري كوري-Marie Curie» وزوجها في عزل بعض المواد المشعة (الراديوم والبولونيوم)، فنال الثلاثة جائزة نوبل في الفيزياء سنة 1903. وللتحقق من طبيعة هذه الأشعة، قام العالم «رذرفورد-Rutherford» بتجربة أخرى. فاكتشف أن هناك ثلاثة أنواع من الأشعة هي: الأشعة α –التي تتميز بشحنتها وبثقلها- والأشعة β -التي تتميز أيضا بشحنتها لكنها أخف من الأولى- وأخيرًا، أشعة γ -التي لا شحنة ولا كتلة لها [1].
تعريف النشاط الإشعاعي وقانونه
يُعَرف النشاط الإشعاعي على أنه احتمالية أن تبعث نواة ما إشعاعات بشكل تلقائي. ويحكم هذه الظاهرة قانون النشاط الإشعاعي، الذي يتنبأ بعدد الإشعاعات المنبعثة عند كل لحظة انطلاقا من عدد النوى (جمع نواة) المتواجدة عند بداية العملية. بعبارة أخرى، إذا علمنا مقدار النوى التي لدينا في اللحظة الصفر، فإننا نستطيع معرفة عدد النوى المتحللة (التي قامت بإصدار إشعاع) في أية لحظة [1]. ويمكن كتابة القانون كالتالي:
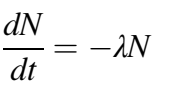
حيث يمثل الجزء الأول من المعادلة dN/dt ، التغير الذي يحصل لعدد النوى مع مرور الوقت. ويمثل N عدد النوى في اللحظة الزمنية t. أما λ فتمثل ثابت الانحلال الذي يميز كل عنصر على حدة. وتُعرَّف λ على أنها احتمالية الانحلال خلال ثانية واحدة. ويمكننا أن نلاحظ أن عدد النوى يتناقص مع الزمن انطلاقا من علامة السالب الموجودة بالمعادلة [1] .
أنواع الانحلال الإشعاعي
للحديث عن أنواع الانحلال الإشعاعي، نُذكِّر أولًا بأن الذرة تتكون من نواة تدور حولها إلكترونات. وأن النواة تتكون بدورها من عدد Z من البروتونات –ذات الشحنة الموجبة- ومن عدد N من النيوترونات –التي لا شحنة لها.
الانحلال α
في هذا الانحلال، تبعث نواة ثقيلة X نواة الهيليوم (الجسيم α) فتتحول إلى نواة جديدة Y حسب التفاعل الآتي:
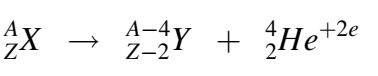
ويمكن أن نلاحظ من خلال المعادلة أن العدد الإجمالي للنويات A (عدد البروتونات والنوترونات) ينحفظ خلال التفاعل أي أنه لا يتغير. وللذكر فقط، فإن عدد بروتونات النواة Z يجب أن يزيد على 80 حتى يتأتى لهذا التفاعل أن يحدث [1].
الانحلال –β
بالنسبة للانحلال –β، فإنه يحدث عادة للنوى التي لها فائض من النيوترونات على حساب البروتونات. حيث تنحو النواة في هذه الحالة إلى تحويل النيوترون إلى بروتون باعثة بذلك الجسيم –β الذي ما هو إلا إلكترون [1]. وتكون المعادلة على الشكل التالي:
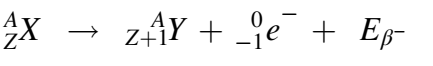
الانحلال +β
على عكس الانحلال –β، فإن هذا التفاعل يُحوّل البروتون إلى نيوترون. وبالتالي فإن النواة تكون مثقلة بالبروتونات على حساب النيوترونات في هذه الحالة. وكما يشير الإسم، فإن الإشعاع المنبعث في هذا التفاعل هو +β (البوزيترون وهو الجسيم المضاد للإلكترون) [1]. وتلخص المعادلة التالية التفاعل الذي يحصل:
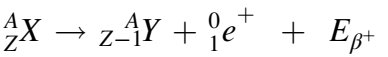
التقاط إلكترون
يتمثل تفاعل التقاط إلكترون في اقتناص النواة لأحد إلكترونات الذرة، والذي يدخل في تحويل البروتون إلى نيوترون. أي أن التفاعل هنا، على عكس الانحلال+β، يحتاج وسيطًا حتى يتم تحول البروتون إلى نيوترون. وكما هو متوقع، فإن النواة الناتجة عن هذا التفاعل هي نفسها التي قد تنتج عن الانحلال+β. ونتيجة لبقاء ثغرة مكان الإلكترون الذي تم امتصاصه، ينزل أحد إلكترونات المدارات العليا ليشغلها، مطلقًا بذلك إشعاعا يحمل فرق الطاقة بين المدارين [1].
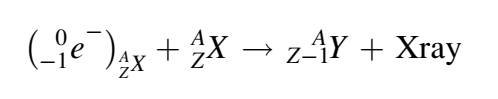
الانحلال γ
على خلاف الأنواع الأولى من التفاعلات، فإن طبيعة النواة في الانحلال γ لا تتغير. لكنها تنتقل من حالة مثارة إلى حالة أكثر استقرارًا. وينبعث إشعاع γ حاملًا معه الطاقة التي فقدتها النواة أثناء التفاعل [1].
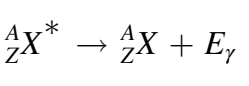
التحويل الداخلي
على غرار انحلال γ، لا تتغير طبيعة النواة في «التحويل الداخلي- Internal Conversion». و بدلًا من انبعاث الإشعاع γ، يمتص أحد إلكترونات الذرة هذا الإشعاع ويستغل طاقته للتحرر من الذرة فينطلق بعيدًا عنها. أما بالنسبة للثغرة التي يتركها الإلكترون الهارب، فيملؤها إلكترون من المدارات العليا مع انبعاث إشعاع يحمل فرق الطاقة بينهما كما بات معروفًا لدينا [1].
الإنشطار التلقائي
في ظاهرة الانشطار النووي، تنقسم نواة ثقيلة إلى نواتين أخف وزنًا. ويختص الانشطار التلقائي بكونه يحدث بشكل طبيعي دون الحاجة إلى محفز (كما يحدث في المفاعلات النووية مثلا) [1].
العوامل التي تحدد خطورة النشاط الإشعاعي
ليس كل ما هو مشع خطير بالضرورة. و تتوقف مدى خطورة مادة مشعة على ثلاثة عوامل رئيسية:
النشاط الإشعاعي للمادة
يحدد النشاط الإشعاعي عدد الإشعاعات المنبعثة في الثانية، وبالتالي عدد الإشعاعات التي يمكن أن يتعرض لها الجسم في مدة معينة. وهكذا، فكلما زاد النشاط الإشعاعي لمادة ما، زادت معه كمية الإشعاعات التي قد يتعرض لها الجسم وبالتالي خطورة المادة لمشعة [2].
طاقة الإشعاع المنبعث
تشكل طاقة الإشعاع المنبعث أثناء الانحلال الإشعاعي أهم عامل في تحديد مدى خطورته على الجسم. ذلك أن قدرة الاختراق لدى نوع معين من الإشعاع ترتبط بشكل رئيسي بطاقته. فكلما زادت الطاقة، زادت معها قدرة الإشعاع على اختراق المادة، وبالتالي قدرته على إلحاق الضرر بالخلايا الحية [2].
نوع الإشعاع
يحدد نوع الإشعاع درجة الحماية التي يجب اتخاذها من أجل منع الإشعاعات من الانتشار في محيطنا. وتعتبر أشعة γ الأشد قدرة على الاختراق، حيث تحتاج عدة سنتيمات من الرصاص لإيقافها. تليها أشعة β -التي تحبسها طبقة رقيقة من الألمنيوم. وفي النهاية، تأتي أشعة α، التي يمكن لمجرد ورقة أن توقفها. ورغم هذا، فلا يمكن أن نحكم بأن الإشعاع α أقل خطورة من الإشعاع γ بالنسبة لطاقة معينة. لأنه رغم عجزها عن اختراق المادة كما تفعل أشعة γ، فإن أثرها على الخلايا الحية أقوى بآلاف المرات من أشعة γ [2].
في الختام، إن النشاط الإشعاعي ظاهرة طبيعية تحيطنا من كل الجهات ولا مهرب منها. وكل ما يمكن فعله حيالها هو اتخاذ التدابير الاحتياطية للحماية منها، خصوصًا بالنسبة للعاملين في مجالات تعرضهم لجرعات كبيرة من الإشعاع.
المصادر
[1] The Physics of Nuclear Reactors
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.



شكرا لكم على نشرالمعرفة و العلم ،و جعله الله في ميزان حسناتكم .