قررت جمعية نوبل في معهد كارولينسكا اليوم منح جائزة نوبل في الفسيولوجيا والطب لعام 2024 مناصفة إلى فيكتور أمبروز وغاري روفكون لاكتشافهما الحمض النووي الريبوزي الميكروي، الرنا الميكروي اختصارا، (microRNA) ودوره في تنظيم الجينات بعد النسخ. تُكرّم جائزة نوبل لهذا العام العالمين لاكتشافهما مبدأ أساسي يحكم تنظيم نشاط الجينات.
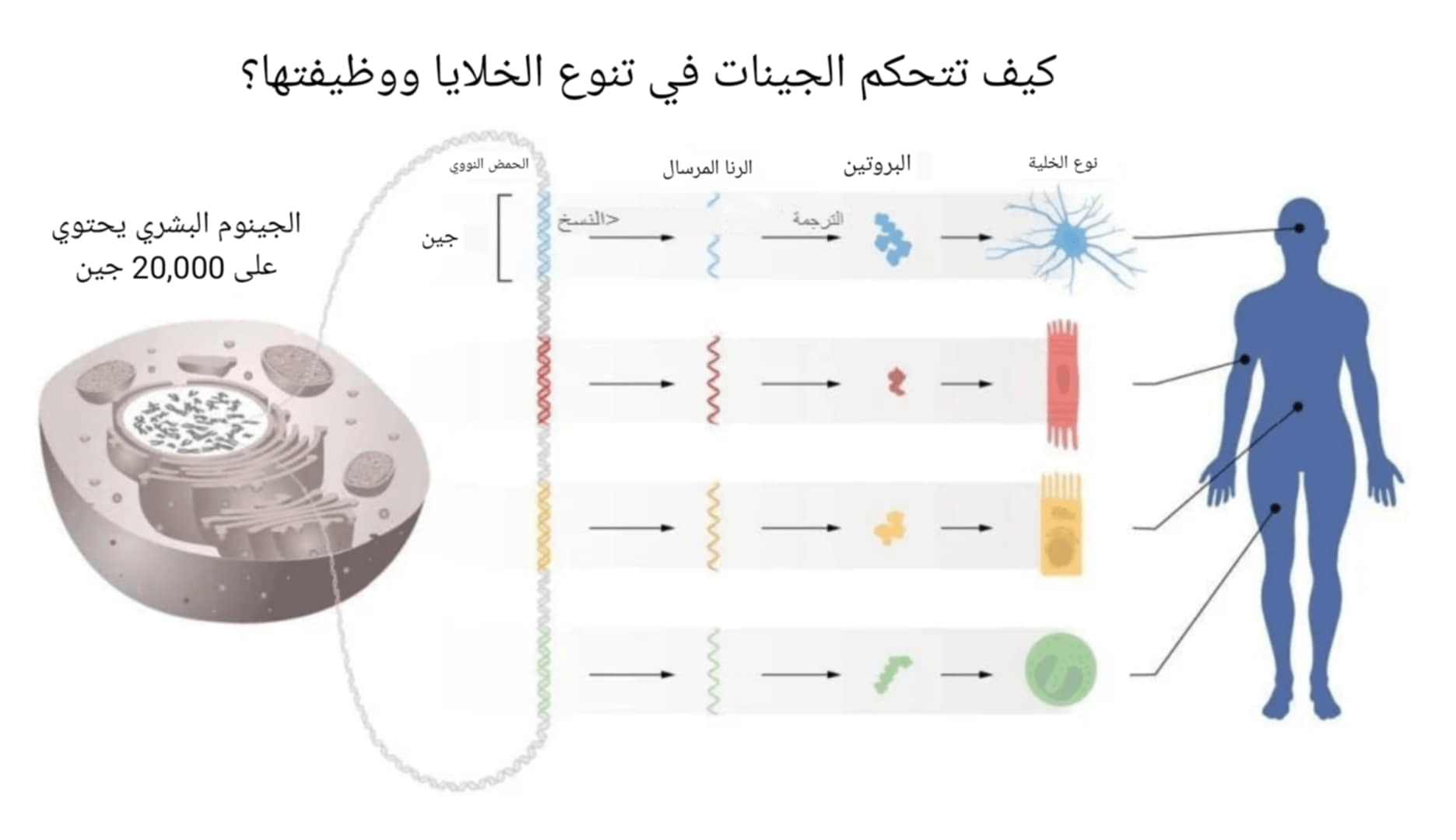
يمكن تشبيه المعلومات المخزنة داخل الكروموسومات لدينا بدليل التعليمات لجميع الخلايا في الجسم. حيث تحتوي كل خلية على نفس الكروموسومات، لذلك تحتوي كل خلية على نفس مجموعة الجينات ونفس مجموعة التعليمات بالضبط. ومع ذلك، فإن أنواع الخلايا المختلفة، مثل الخلايا العضلية والخلايا العصبية، لها خصائص مميزة.

ولكن كيف تنشأ هذه الاختلافات؟ تكمن الإجابة في التنظيم الجيني، الذي يسمح لكل خلية باختيار التعليمات ذات الصلة فقط. وهذا يضمن أن المجموعة الصحيحة من الجينات هي فقط النشطة في كل نوع من الخلايا. كان فيكتور أمبروز وغاري روفكون مهتمين بكيفية تطور أنواع الخلايا المختلفة. حيث اكتشفوا الرنا الميكروي. لقد اكتشفوا مبدأ جديد تمامًا لتنظيم الجينات والذي تبين أنه ضروري للكائنات متعددة الخلايا، بما في ذلك البشر. ومن المعروف الآن أن الجينوم البشري يرمز لأكثر من ألف من الرنا الميكروي.
محتويات المقال :
فهم تنظيم الجينات
يتكون جسم الإنسان من تريليونات الخلايا، ولكل منها مجموعة فريدة من الخصائص والوظائف. لكن هل تساءلت يومًا كيف تعرف هذه الخلايا ما يجب عليها فعله ومتى تفعله؟ الجواب يكمن في مخطط الحياة، حمضنا النووي.
ولكن كيف تتم ترجمة هذه المعلومات من حمضنا النووي؟ تنظيم الجينات (gene regulation) هو العملية التي تحدد من خلالها الخلايا الجينات التي سيتم تشغيلها أو إيقافها، ومتى يتم ذلك. إنها مثل أوركسترا معقدة، حيث كل جين هو أداة مختلفة، والخلية هي المايسترو، مما يضمن عزف الآلات المناسبة في الوقت المناسب لخلق الانسجام.
لعقود من الزمن، ظل العلماء يحاولون فهم كيفية عمل تنظيم الجينات. واكتشفوا أن البروتينات المتخصصة، التي تسمى عوامل النسخ (Transcription factor)، تلعب دورًا حاسمًا في التحكم في تدفق المعلومات الوراثية. ترتبط هذه البروتينات بمناطق معينة في الحمض النووي، مما يحدد الجينات التي يتم تشغيلها أو إيقاف تشغيلها. ولكن على الرغم من هذه الاكتشافات، لا تزال هناك قطعة مفقودة من اللغز.
ما هو الرنا الميكروي نجم نوبل الطب 2024؟
الرنا الميكروي هي جزيئات حمض نووي ريبوزي صغيرة غير مشفرة تلعب دورًا حاسمًا في تنظيم التعبير الجيني. توجد هذه الجزيئات، التي يبلغ طولها عادةً من 21 إلى 23 نوكليوتيدًا، في مجموعة واسعة من الكائنات الحية، بما في ذلك النباتات والحيوانات والفيروسات.
في الأساس، يعمل الرنا الميكروي كـ”مفاتيح” صغيرة يمكنها تشغيل الجينات أو إيقافها، مما يؤثر على مجموعة واسعة من العمليات البيولوجية. وقد يؤدي اختلال تنظيمها إلى عواقب وخيمة على صحة الإنسان.
آلية العمل
- النسخ: يتم نسخ الرنا الميكروي من تسلسلات الحمض النووي (DNA) داخل الجينوم.
- المعالجة: تتم معالجة هذه النسخ إلى رنا ميكروي ناضج، وهي جزيئات أحادية السلسلة.
- التعرف على الهدف: يرتبط الرنا الميكروي الناضج بتسلسلات محددة، غالبًا داخل المنطقة غير المترجمة 3′ (UTR 3′)، لجزيئات الرنا المرسال (mRNA).
- التنظيم الجيني: يمكن أن يؤدي هذا الارتباط إلى تحلل الرنا المرسال (mRNA degradation)، حيث يمكن للرنا الميكروي توجيه الإنزيمات لتحلل الرنا المرسال. كما يؤدي إلى القمع الترجمي (Translational repression) حيث يمكن للرنا الميكروي تثبيط تخليق البروتين من الرنا المرسال.
الأهمية البيولوجية
- التطور والتمايز: يعد الرنا الميكروي ضروري لتطور الخلايا والأنسجة وتمايزها.
- المرض: يرتبط خلل تنظيم الرنا الميكروي بأمراض مختلفة، بما في ذلك السرطان وأمراض القلب والأوعية الدموية والاضطرابات العصبية التنكسية.
- الإمكانات العلاجية: إن فهم وظائف الرنا الميكروي يوفر طرقًا واعدة لتطوير استراتيجيات علاجية جديدة.
دراسة الدودة الاسطوانية
كانت الكائنات الحية النموذجية حقيقية النواة ذات قيمة لا تقدر بثمن في مجال البحوث الجينية، حيث أسفرت عن العديد من الاكتشافات غير المتوقعة. فقد قدم سيدني برينر دودة أحد أنواع الديدان الأسطوانية الشفافة تسمى الربداء الرشيقة (C. elegans) منذ أكثر من خمسة عقود.
وقد سهّلت مدة الجيل القصيرة لهذا الكائن الحي، وشفافيته، وسهولة التلاعب الجيني به، إجراء دراسات موسعة. واستخدم سيدني برينر وجون سولستون وروبرت هورفيتز الربداء الرشيقة لكشف كيفية التحكم الجيني في انقسام الخلايا وتمايزها وموتها أثناء نمو الأعضاء، وهي الاكتشافات التي نالوا عنها جائزة نوبل في الفسيولوجيا عام 2002.
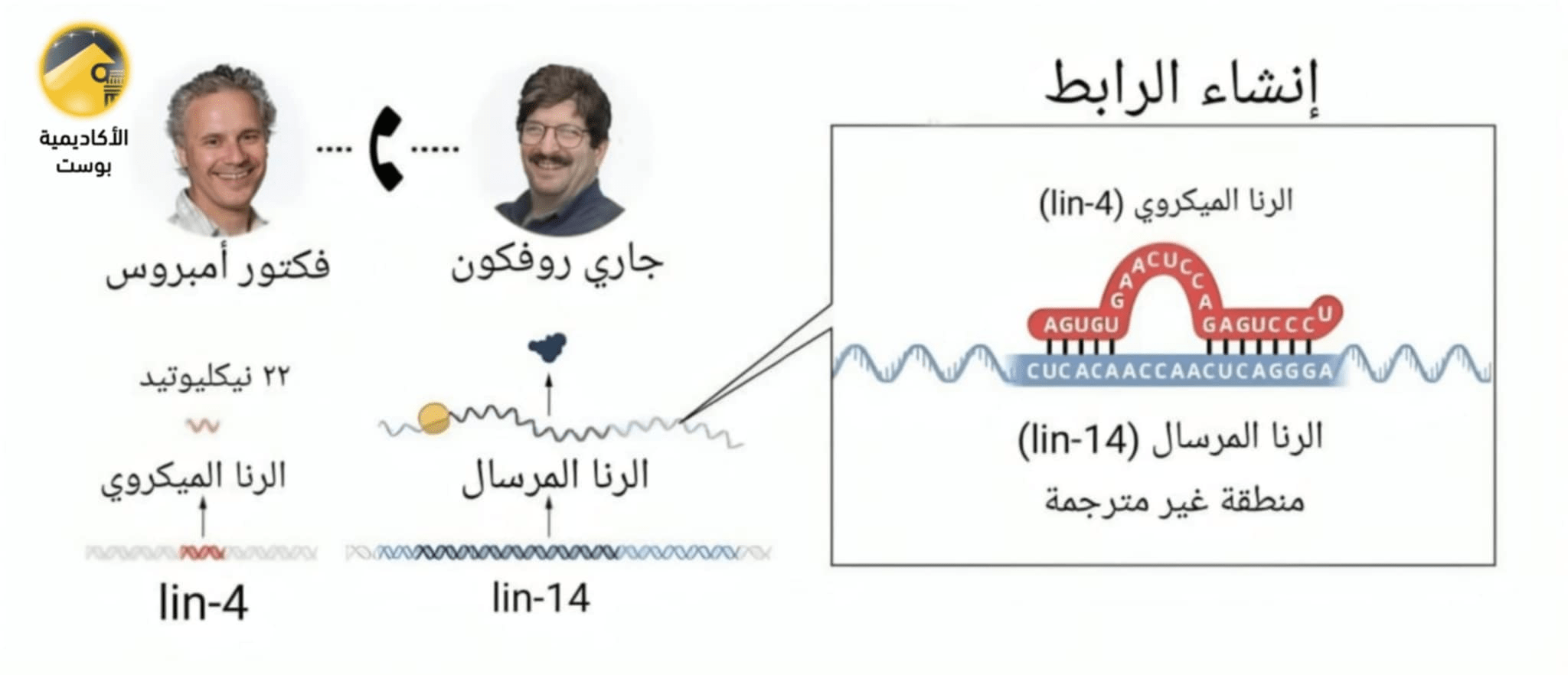
في سبعينيات القرن العشرين، كشفت عمليات فحص الطفرات التي أجريت في مختبر برينر على الربداء الرشيقة عن الطفرة lin-4 (e912). أظهرت هذه الديدان نمطًا ظاهريًا مذهلاً، فقد غابت تمامًا العديد من أنواع الخلايا والهياكل المورفولوجية، وتراكم البيض بسبب فشل في نمو الفرج، ويبدو أن هذا يرجع إلى تكرار برامج التطوير لسلالات خلوية محددة.
الاكتشاف الذي مهد الطريق إلى نوبل الطب 2024
ظل الرنا الميكروي وطريقة تنظيم الجينات الخاصة به غير معروفة تمامًا حتى اكتشفها فيكتور أمبروز وجاري روفكون في عام 1993. وقد قام الحائزان على جائزة نوبل بفحص الربداء الرشيقة التي تعاني من عيوب نمو ناجمة عن تغيرات في المواقع الكروموسومية (lin-4) و(lin-14). المواقع الكروموسومية تعبر عن المَوقع المُحدد الذي يشغله جين مُعين عَلى الكروموسوم.
وقد استنسخ مختبر أمبروز جين (lin-4) وتوصل إلى اكتشاف مدهش مفاده أنه لا يشفر بروتينًا. بدلاً من ذلك، قام بتشفير حمض نووي ريبوزي قصير غير مشفر مكون من 22 نوكليوتيد. وبالتوازي مع ذلك، حدد مختبر روفكون أن (lin-4) ينظم (lin-14) عبر عناصر متعددة في المنطقة غير المترجمة 3′ (3’UTR)، وهي منطقة في الرنا المرسال.
عند مقارنة معلومات التسلسل، حددوا التكاملية الجزئية للتسلسل بين الحمض النووي الريبوزي القصير غير المشفر (lin-4) وعناصر (3’UTR) من (lin-14). قدم هذا لمحة أولى عن نوع جديد من الحمض النووي الريبوزي التنظيمي المسمى بالرنا الميكروي.
في عام 2000، كشف مختبر روفكون عن (microRNA let-7) المحفوظ للغاية، مما أدى إلى التعرف اللاحق على الرنا الميكروي المتجانس عبر أنواع حيوانية متنوعة، بما في ذلك البشر. أثار هذا جهودًا مكثفة في الاستنساخ والتسلسل لتحديد الرنا الميكروي في جميع أنحاء مملكة الحيوان، مما أدى إلى اكتشاف أن الرنا الميكروي يشمل مجموعة كبيرة من المنظمات التي تتحكم في شبكات واسعة من الجينات المشفرة للبروتين.
وكان اكتشاف أمبروس وروفكون غير متوقع على الإطلاق، حيث كشف النقاب عن آلية تنظيمية ما بعد النسخ محفوظة تطوريًا بوساطة الرنا الميكروي، والتي تلعب دورًا حاسمًا في نمو الحيوانات ووظيفة الأنسجة البالغة.
حقوق الصورة: الموقع الرسمي لجوائز نوبل
تأثير هذا الاكتشاف
كان لاكتشاف الرنا الميكروي تأثيرًا عميقًا على فهمنا لتنظيم الجينات ودوره في التطور والمرض. وُجد أن جزيئات الحمض النووي الريبوزي (RNA) الصغيرة تلعب دورًا حاسمًا في تنظيم التعبير الجيني، كما أن خلل تنظيمها متورط في أمراض مختلفة، بما في ذلك السرطان والسكري واضطرابات التنكس العصبي.
أثناء التطوير، يساعد الرنا الميكروي على ضبط التعبير الجيني، مما يضمن تشغيل الجينات الصحيحة أو إيقاف تشغيلها في الوقت المناسب. يعد هذا التنظيم الدقيق ضروريًا لتكوين الأعضاء والأنسجة، وأي خلل يمكن أن يؤدي إلى تشوهات في النمو.
في المرض، يمكن أن يكون لخلل تنظيم الرنا الميكروي عواقب مدمرة. على سبيل المثال، في حالة السرطان، يمكن أن يعمل كمثبط للورم أو جينات مسرطنة، اعتمادًا على السياق الخلوي. لقد تم ربط التعبير غير الطبيعي للرنا الميكروي بأنواع مختلفة من السرطان، بما في ذلك سرطان الثدي والرئة والقولون. علاوة على ذلك، فقد تورط أيضًا في اضطرابات التنكس العصبي مثل مرض الزهايمر ومرض باركنسون، حيث قد يلعب دورًا في تنظيم التعبير عن الجينات المشاركة في وظيفة الخلايا العصبية وبقائها.
إن التطبيقات المحتملة للرنا الميكروي في الطب واسعة النطاق. ويستكشف الباحثون استخدامه كمؤشر حيوي لتشخيص الأمراض ومراقبتها، فضلاً عن كونه هدفًا علاجيًا لعلاج الأمراض. بالإضافة إلى ذلك، فإن العلاج الجيني المعتمد على الرنا الميكروي يبشر بالخير في علاج الاضطرابات الوراثية.
المصدر
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.



التعليقات :