محتويات المقال :
بطاريات الليثيوم الفائزة بجائزة نوبل الكيمياء 2019 ، كيف تعمل؟ وما أهميتها في حياتنا؟
بطاريات الليثيوم الفائزة بجائزة نوبل الكيمياء 2019 حولك في كل مكان، في هاتفك النقّال وفي سيارتك وفي حاسوبك المحمول وغيرها من الأجهزة التي لا تُلزمك الإلتصاق بجانب قابس الكهرباء كي تبقى حية، في هذا المقال سنأخذكم معنا في جولة إلى عالم البطاريات وتطورها لتعرف كيف تعمل؟ وما أهميتها في حياتنا؟ وصولا إلى بطاريات الليثيوم التي كانت سببا لنيل جائزة نوبل في الكيمياء عام 2019.

مبدأ عمل البطارية بوجه عام
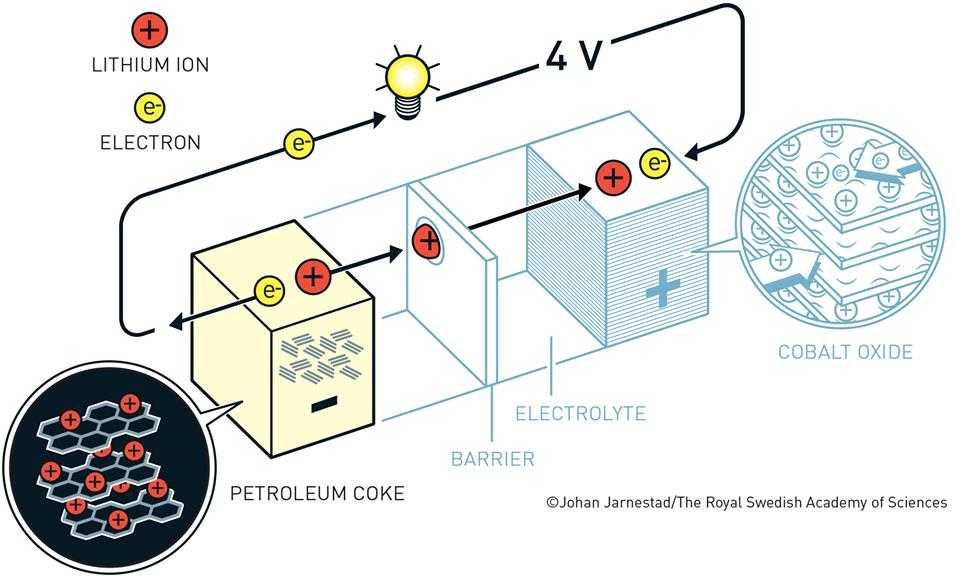
تحتوي البطارية على عدد من الخلايا والتي تتكون من قطبان موصولان بدارة كهربائية ويفصل بين القطبين محلول أيوني يحوي أيونات موجبة وسالبة، كما يفصل بين القطبان حاجز يمنع تكون دارة كهربائية قصيرة. تبدأ عملية الشحن بأكسدة القطب السالب والذي يعرف بـ«الأنود»، مما يؤدي إلى حركة الألكترون خلال الدارة بإتجاه القطب الموجب المسمى «كاثودا» فيختزل الإلكترون القادم من الدارة، وتعتمد فولتية البطارية على مقدار فرق الجهد بين القطبين وتتم كامل العملية بصورة لحظية أما عملية إعادة الشحن فتتم بصورة عكسية غير لحظية وتحتاج إلى مصدر كهربائي خارجي.
بدايات بطاريات الليثيوم الفائزة بجائزة نوبل الكيمياء 2019
أولى البطاريات ظهوراً هي البطارية الفولتية والتي يمثل فيها عنصر «الزنك» الأنود الذي ينتج الإلكترون للدارة، على الجهة المقابلة يقف كاثود النحاس معتمدا على الظروف المحيطة، ففي جوٍ مليء بالأكسجين يتأكسد النحاس جزئيًا إلى CuO ومن ثم يختزل إلى «النحاس» الحُر مجددًا. أما في غياب الأكسجين يُختزل البروتون الموجود في المحلول الأيوني إلى الهيدروجين على سطح النحاس وتصل فولتية البطارية ما بين 0,8 – 1,1 إعتمادًا على المحيط، كما أن هذه البطارية غير قابلة لإعادة الشحن.
بطاريات (الرصاص-الحمض) المستخدمة كبطارية ابتدائية للسيارات تتشابه إلى حدٍ كبير مع البطارية الفولتية، لكنها تختلف عنها في خاصية إعادة الشحن، نذكر أيضا بطارية «النيكل- الحديد» وبطارية «النيكل-الكادميوم» والتي تعتبر أسلافًا لبطارية «النيكل-الهيدرايد الفلزي».
الليثيوم
تم اكتشاف عنصر الليثيوم عام 1817، بعدده الذري 3، وبكثافته التي لا تتجاوز 0,53 جم/مل ويعد أخف عنصر فلزي كما أنه يمتلك جهد اختزال معياري منخفض، مما يجعله مرشحًا قويًا مناسبًا لخلايا البطاريات عالية الفولتية ومرتفعة الكثافة، وبما أنه عنصر نشط سريع التفاعل، فهو ما يستوجب حمايته وعدم تعريضه للهواء.
تخلل الكاثود
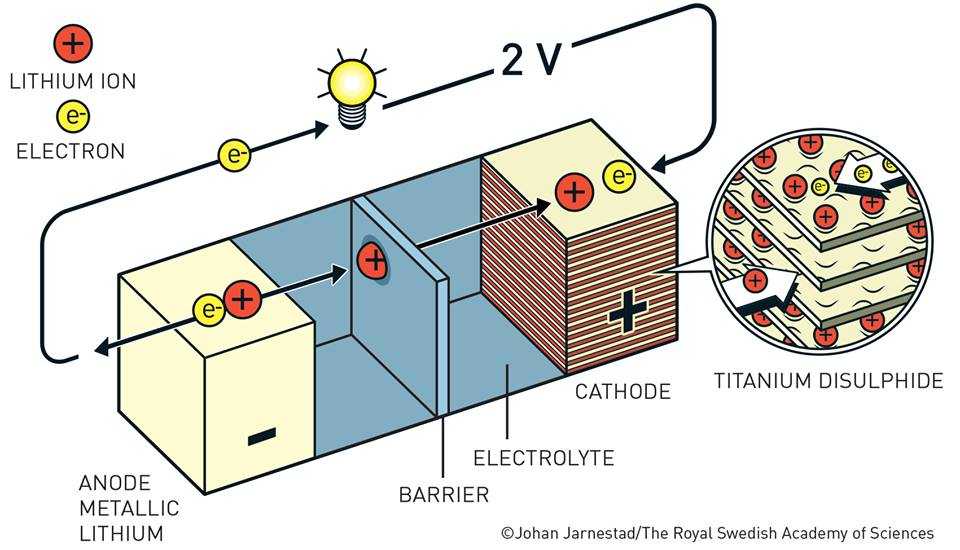
نظرا لأن مرشحنا وعنصرنا النشط قد استحوذ على إعجاب العلماء حيث نصبوه أنودًا، اتجهت الأنظار وقتها لإيجاد كاثود مناسب يحقق جهد فولتي عالي، وقد وقع الإختيار على «TiS2» حيث أثبت هذا المركب قدرته على إحتواء الكترون الليثيوم. فالترتيب الصفائحي لمركب TiS2 وبينها أيونات الليثيوم، سمح لها بالتخلل، كما قدم العالم «والتر رودف-Walter Rudoff» التخلل الكيميائي في الأمونيا السائلة منتجًا «Li(0.6)/TiS2»، لكن الثورة الحقيقية كانت عندما استطاع «إم ستانلي وايتيجتون-M.Stanely Whittington» و «فريد جامبل-Fred Gamble» إيضاح أن عملية التخلل تتم ضمن الصيغة «Li(x)TiS2» حيث x أكبر من صفر وأقل أو تساوي واحد. هذه المادة كانت نظير «CdI(2)-NiAs» وأيونات الليثيوم وهذا بدوره حفز وايتنجون لإكتشاف التخلل الكهروكيميائي في هذه المواد، ومع بداية 1973 قدّم هذه المواد كأقطاب في البطاريات.
خلية بطاريات الليثيوم الفائزة بجائزة نوبل الكيمياء 2019
خلية البطارية مكونة من عنصر الليثيوم كـ أنود و«TiS2» كـ كاثود و«LiPF6» كمحلول أيوني مُذاب في «كربونات البروبيلين-Propylene carbonate» القوة المُحركة الكهربائية للخلية تقترب من 2.5 فولت وتظهر كثافة التيار الأساسي قريبة من ١٠ مترأمبير لكل سم مربع وهذا يعطينا: «(XLi + TiS(4) – → Li(x)TiS(2» ويستمر التفاعل بتخلل أيونات الليثيوم في شبكة «TiS2».
عملياً:
يتم خلط بودرة TiS2 مع «التفلون-Teflon» وترتبط مع داعم معدني مُحاط بفلز بولي بروبالين ومعدن الليثيوم. ولزيادة مرونة الدارة وحركتها بنسبة ١١٠٠ مرة أكبر، يتم غمس خليط من «تيتراهيدروفيوران-Tetrahydrofuran» و «Dimethoxyethane» يحوي على «LiClO 4».
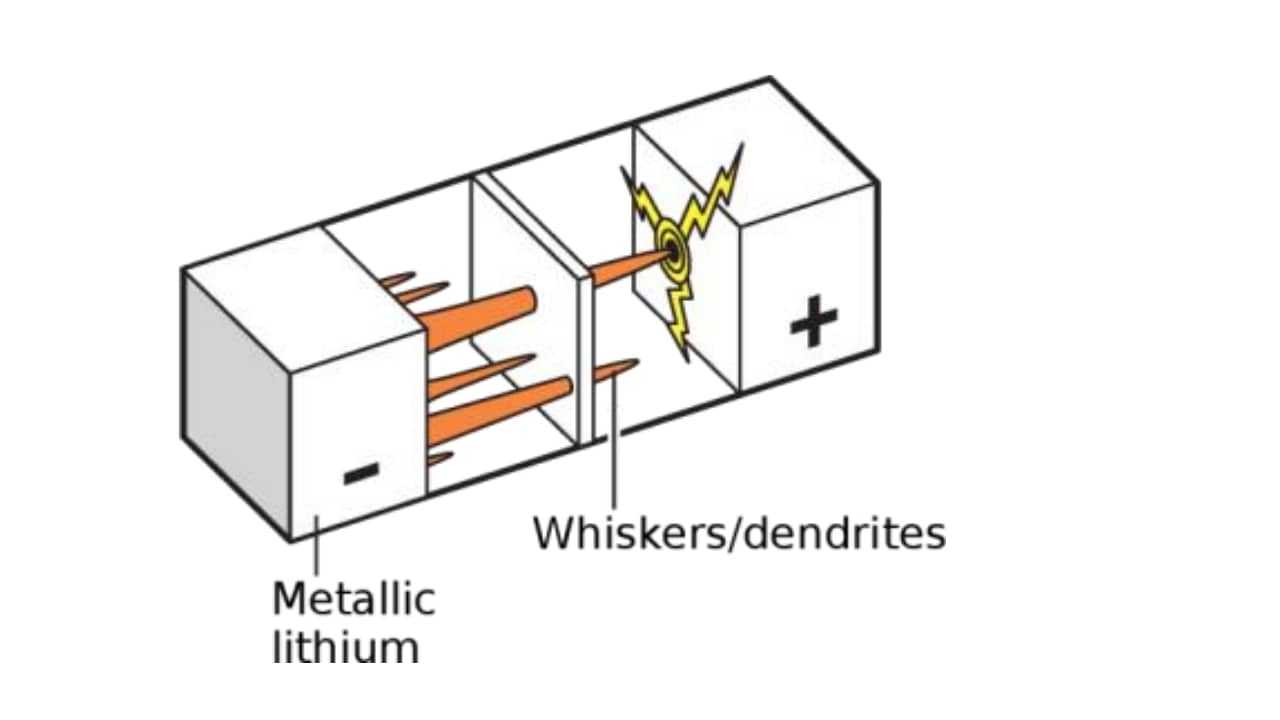
المشكلة التي نسعى لحلها الآن هي حماية الليثيوم وتقليل تفاعله مع الجو، حيث أنه تم العثور على زوائد شجرية تكونت على سطح الخلية لها القدرة على اختراق الطبقة العازلة والوصول إلى القطب الآخر وبالتالي تكون دارة قصيرة أدت إلى انفجارات.
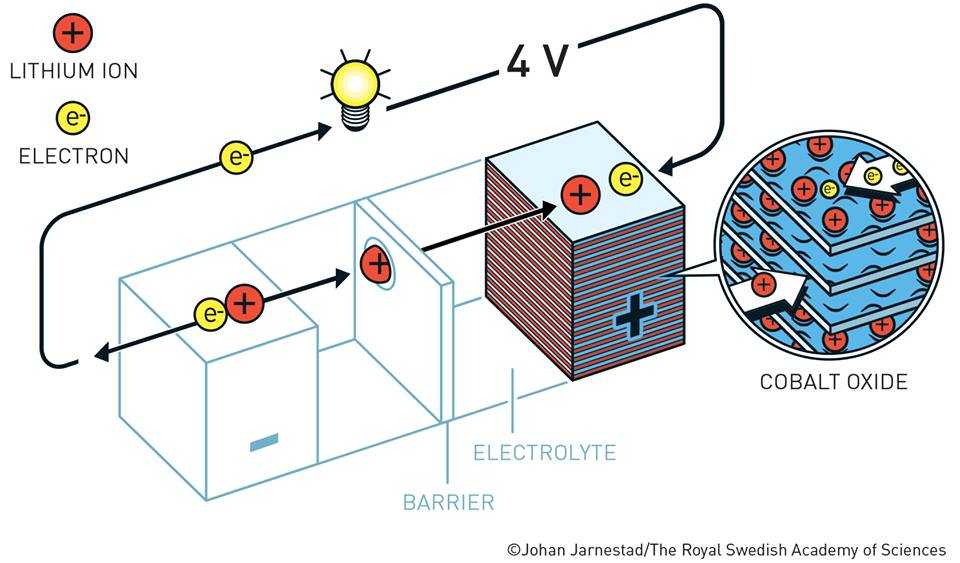
الحل أتى في نهاية عام 1979:
على يد «جون جودنوف-John B.Goodenough» وزملائه في جامعة أكسفورد الفائزون بنوبل الكيمياء 2019 وفقًا لبيان اللجنة العلمية لنوبل ، حيث وجد أن «Li(x)CoO» وهو مركب نظير «Li(x)TiS 2» من الممكن أن يعمل كـ «كاثود» لكن بدون توسع الشبكة حيث أن عنصر صغير سالب الشحنة كالأكسجين الذي سيأخذ الأيون الموجب بعملية مصحوبة بتغير أكبر في الطاقة الحرة السالبة وبفولتية أعلى كما أنه سيُتاح لأيونات الليثيوم حركة كافية في شبكات الأكسجين المغلفة المُغلقة، وقد تحقق ذلك مع فرق جهد وصل 5,4 فولت.
الثورة الثالثة في عالم البطاريات:
تمت في عام 1985 على يد مجموعة بقيادة «اكيرا يوشين- Akira Yoshin» حيث لجأ إلى مركبات الفحم البترولية المستقرة، تتكون هذه المادة من خليط كريستالي وغير كريستالي، وبإستخدام درجة كريستالية محددة ومستقرة بحيث تشكل المنطقة المحيطة حماية للجزء الكريستالي، فاستطاعت أيونات الليثيوم وبشكل متكرر التخلل في هذه المواد. طوّر يوشين بطارية الليثيوم إعتمادًا على ترتيب إنتقال الأيون في الخلية، واستخدم الكربون كـ «أنود» و«Li(x)CoO 2» ك «كاثود»، وتتألف الطبقة العازلة من البولي ايثلين أو بولي بروبولين، والمحلول الأيوني عبارة عن «LiClO 4» المُذاب في كربونات البروبولين. هذه التطورات أدت إلى إنتاج بطاريات الليثيوم تجاريا عام 1991 بفولتية تصل إلى 4.1 و بكثافة طاقة أقتربت من 200 وات لكل لتر، واتضح أن أدخال الجرافيت مع المكونات الأيونية المناسبة بدوره قد يوصل الفولتية إلى 4.2 وبطاقة تقترب من 400 وات لكل لتر.
المصادر:
بيان جائزة نوبل الكيمياء العلمي 2019
(1) Volta, A. On the Electricity Excited by the Mere Contact of Conducting Substances of Different
Kinds. Philos. Trans. Royal Soc. 1800, 90, 403–431.
(2) Planté, G. Nouvelle Pile Secondaire d’une Grande Puissance. Comptes Rendus Acad. Sci.
1860.
(3) Planté, G. The Storage of Electrical Energy: And Researches in the Effects Created by
Currents Combining Quantity with High Tension; London: Whittaker, 1887.
(4) Placke, T.; Kloepsch, R.; Dühnen, S.; Winter, M. Lithium Ion, Lithium Metal, and Alternative
Rechargeable Battery Technologies: The Odyssey for High Energy Density. J. Solid State
Electrochem. 2017, 21 (7), 1939–1964.
(5) Munro, J. Pioneers of Electricity; or, Short Lives of the Great Electricians; London: The
Religious Tract Society, 1890.
(6) Sinsteden, W. J. Versuche über den Grad der Continuität und die Stärke des Stroms eines
grössern magneto-elektrischen Rotations. Ann. Phys. Chem. 1854, 92, 1–21.
(7) Gautherot, N. Sur le galvanisme. Ann. Chim. 1801, 39, 203–210.
(8) Jungner, E. W. Sätt att på elektrolytisk väg förstora ytan af sådana metaller, hvilkas
syreföreningar äro kemiskt olösliga i alkaliska lösningar. Swedish patent no. 15567, 1901.
(9) Jungner, E. W. Primärt eller sekundärt elektriskt element. Swedish patent no. 10177, 1899.
(10) Edison, T. A. Reversible Galvanic Battery. US patent no. 692,507, 1902.
(11) Arfwedson, J. A. Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien
und von einem darin gefundenen neuen feuerfesten Alkali. J. Chem. Phys. 1818, 22, 93–117.
(12) Berzelius, J. J. Ein neues mineralisches Alkali und ein neues Metall. J. Chem. Phys. 1817, 21,
44–48.
(13) Glaize, C.; Genié, S. Lithium Batteries and Other Electrochemical Storage Systems; ISTE
Ltd., 2013.
(14) Lewis, G. N.; Keyes, F. G. The Potential of the Lithium Electrode. J. Am. Chem. Soc. 1913,
35, 340–344.
(15) Harris, W. S. Electrochemical Studies in Cyclic Esters; PhD thesis, University of California,
Berkeley, 1958.
(16) Yao, Y.-F. Y.; Kummer, J. T. Ion Exchange Properties of and Rates of Ionic Diffusion in BetaAlumina. J. Inorg. Nucl. Chem. 1967, 29 (9), 2453–2475.
(17) Kummer, J. T.; Neill, W. Thermo-Electric Generator. US patent No. 3,458,356, 1969.
(18) Newman, J. Transport in Electrolytic Solutions. Adv. Electrochem. Electrochem. Eng. 1967,
5, 87–135.
(19) Whittingham, M. S. Chemistry of Intercalation Compounds: Metal Guests in Chalcogenide
Hosts. Prog. Solid State Chem. 1978, 12 (1), 41–99.
(20) Rüdorff, W. Chimia 1965, 19, 489.
(21) Bichon, J.; Danot, M.; Rouxel, J. Systematique Structurale Pour Les Series d’intercalaires
Mxtis2 (M= Li, Na, K, Rb, Cs). Comptes Rendus Acad. Sci., Ser. C, Sci. Chim. 1973, 276, 1283–
1286.
(22) Whittingham, M. S.; Gamble, F. R. The Lithium Intercalates of the Transition Metal
Dichalcogenides. Mater. Res. Bull. 1975, 10 (5), 363–371.
(23) Whittingham, M. S. Electrointercalation in Transition-Metal Disulphides. J. Chem. Soc.,
Chem. Commun. 1974, 328–329.
(24) Whittingham, M. S. Batterie à Base de Chalcogénures. Belgian patent no. 819672, 1975.
(25) Whittingham, M. S. Electrical Energy Storage and Intercalation Chemistry. Science 1976,
192 (4244), 1126–1127.
(26) Whittingham, M. S. History, Evolution, and Future Status of Energy Storage. Proc. IEEE
2012, 100, 1518–1534.
(27) Armand, M. B. Intercalation Electrodes. In Materials for Advanced Batteries. NATO Conf.
Ser. (VI Mater. Sci.); Murphy, D. W., Broadhead, J., Steele, B. C. H., Eds.; Springer, Boston, MA,
1980, 2, 145–161.
(28) Armand, M.; Touzain, P. Graphite Intercalation Compounds as Cathode Materials. Mater.
Sci. Eng. 1977, 31, 319–329.
(29) Rüdorff, W.; Hofmann, U. Über Graphitsalze. Z. Anorg. Allg. Chem. 1938, 238, 1–50.
(30) Schafhaeutl, C. Über die Verbindungen des Kohlenstoffes mit Silicium, Eisen und anderen
Metallen, welche die verschiedenen Gallungen von Roheisen, Stahl und Schmiedeeisen bilden. J.
Prakt. Chem. 1840, 3, 129.
(31) Fredenhagen, K.; Cadenbach, G. Die Bindung von Kalium durch Kohlenstoff. Z. Anorg. Allg.
Chem. 1926, 158, 249.
(32) Goodenough, J. B.; Mizushima, K. Fast Ion Conductors. US patent no. 4,357,215, 1982.
(33) Mizushima, K.; Jones, P. C.; Wiseman, P. J.; Goodenough, J. B. LixCoO2 (0<x<-1): A New
Cathode Material for Batteries of High Energy Density. Mater. Res. Bull. 1980, 15 (6), 783–789.
(34) Yoshino, A.; Sanechika, K.; Nakajima, T. Secondary Battery. US patent no. 4,668,595, May
26, 1987.
(35) Yoshino, A.; Sanechika, K.; Nakajima, T. Japanese patent no. 1989293, 1985.
(36) Yoshino, A. The Birth of the Lithium-Ion Battery. Angew. Chem. Int. Ed. 2012, 51, 5798–
5800.
(37) Nishi, Y. The Development of Lithium Ion Secondary Batteries. Chem. Rec. 2001, 1, 406–
413.
(38) Fong, R.; Sacken, U. von; Dahn, J. R. Studies of Lithium Intercalation into Carbons Using
Nonaqueous Electrochemical Cells. J. Electrochem. Soc. 1990, 137 (7), 2009–2013.
(39) Peled, E. The Electrochemical Behavior of Alkali and Alkaline Earth Metals in Nonaqueous
Battery SystemsThe Solid Electrolyte Interphase Model. J. Electrochem. Soc. 1979, 126 (12),
2047–2051.
(40) Padhi, A. K.; Nanjundaswami, K. S.; Goodenough, J. B. Phospho-Olivines as PositiveElectrode Materials for Rechargeable Lithium Batteries. J. Electrochem. Soc. 1997, 144, 1188–
1194.
(41) Thackeray, M. M.; David, W. I. F.; Bruce, P. G.; Goodenough, J. B. Lithium Insertion into
Manganese Spinels. Mater. Res. Bull. 1983, 18, 461–472.
بطارية الليثيوم الفائزة بجائزة نوبل الكيمياء 2019 المستخدمة في حياتنا يوميًا
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.





التعليقات :