أثناء عملية العلاج الإشعاعي، يتلقى المريض حزما من الإشعاعات التي تستعمل لقتل الخلايا السرطانية. ويختلف نوع الحزم المستعملة حسب المنطقة المعالجة. فكيف يتم إنتاج الإشعاعات المستعملة في العلاج الإشعاعي؟
محتويات المقال :
كيفية إنتاج الإشعاعات المستعملة في العلاج الإشعاعي
تعتمد تقنية العلاج الإشعاعي على قتل الخلايا السرطانية بفعل الطاقة التي تتركها الحزم الإشعاعية في الورم. ويختلف تأثير الحزم الإشعاعية حسب نوعها. فبعضها يترك معظم طاقته فور دخوله جسم المريض (الإلكترونات)، بينما تخترق أخرى عدة سنتيمترات من جسم المريض قبل أن تخسر طاقتها (الفوتونات). وباختلاف نوع الحزم أيضًا، تختلف طرق إنتاجها. فإنتاج الإلكترونات ليس كإنتاج أشعة غاما، وإنتاج الأشعة السينية ليس كإنتاج الجسيمات الثقيلة.
الأشعة السينية
تعتبر الأشعة السينية الأكثرَ استعمالا في مجال العلاج الإشعاعي. ويتم إنتاجها من خلال قذف هدف بحزم من الإلكترونات التي تتراوح طاقتها بين 10keV و50MeV. بعد اصطدام الإلكترونات بالهدف، تنبعث كمية كبيرة من الطاقة على شكل حرارة (أكثر من %99)، بالإضافة إلى نسبة ضئيلة من الأشعة السينية (أقل من %1) [1].
هناك نوعان من الأشعة السينية، ويختلف باختلاف نوع التفاعل: «الأشعة السينية المميزة-Characteristic X rays » و«الأشعة السينية الانكباحية-Bremsstrahlung X rays ». تنتج الأشعة السينية المميزة عن تفاعل الإلكترون المقذوف مع إلكترونات المادة الهدف، حيث تقتلع طاقة التصادم أحد إلكترونات المادة الهدف من مساره مخَلِّفة فجوة مكانه. بعدها، ينزل أحد إلكترونات المستويات الأعلى لملء هذه الفجوة محررًا معه طاقة -تساوي الفرق الطاقي بين المستويين- على شكل فوتون (الشكل 1).
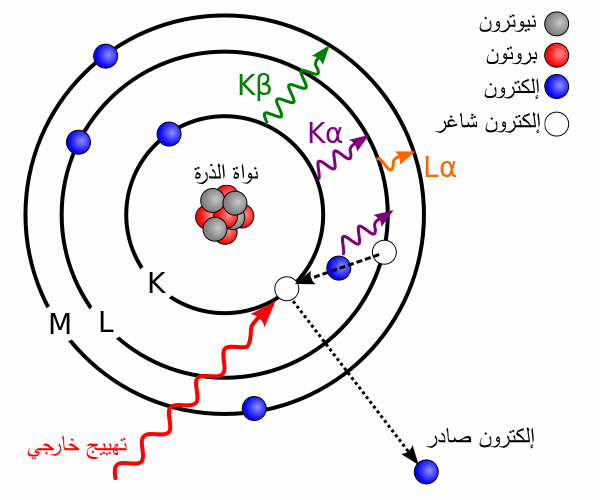
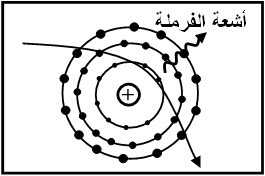
أما الأشعة السينية الانكباحية، فتنتج عن تفاعل الإلكترون مع المجال الكهربي لنواة الذرة. فبعد دخول الإلكترون للمجال الكهربي للنواة، يتباطأ الإلكترون محررًا معه ما فوتونًا بطاقة تتراوح بين الصفر والطاقة الحركية للإلكترون المقذوف (الشكل 2) [1].
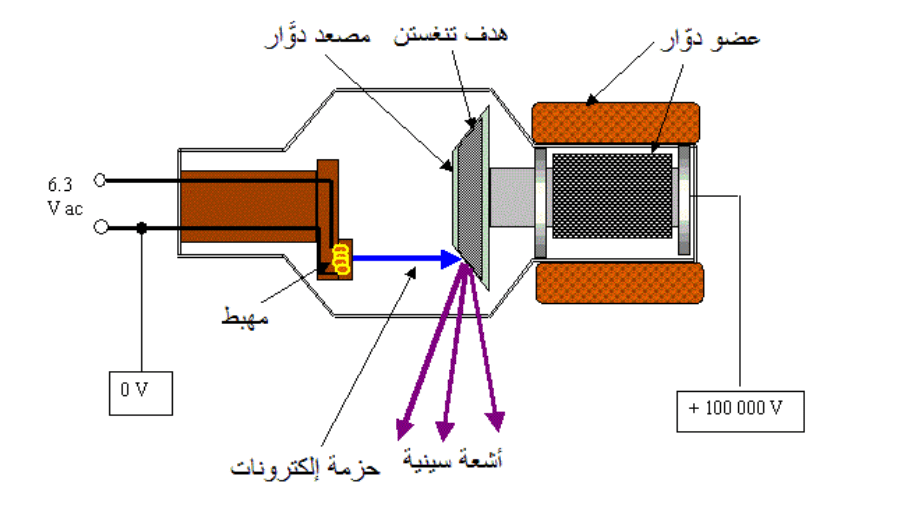
وتختلف عملية إنتاج الأشعة السينية حسب الطاقة المراد تحصيلها. حيث ينتِج «أنبوب الأشعة السينية-X-ray tube» إشعاعات ذات طاقة منخفضة (أصغر من keV100). بينما يستعمَل المُسرِّع الخطي في إنتاج إشعاعات عالية الطاقة (أكبر من MeV1). بالنسبة لأنبوب الأشعة السينية، يتم تسخين سلك معدني من أجل إضعاف طاقة الربط بين ذرات السلك والإلكترونات الخارجية لهذه ذرات. بعدها، يطبَّق فرق جهد بين السلك والمادة الهدف من أجل توجيه هذه الإلكترونات نحو الهدف لخلق التفاعل (الشكل 3). وبما أن كمية كبيرة من الحرارة تنتج عن هذا التفاعل، فإن أنبوب الأشعة السينية يكون دائما مصحوبًا بنظام تبريد، بالإضافة إلى مولّد من أجل تطبيق فرق الجهد. بالنسبة للمسرع الخطي، فقبل أن تصل الإلكترونات إلى الهدف، يتم تطبيق نظام لتسريع الإلكترونات حتى تصل لطاقات عالية من أجل الحصول على أشعة سينية ذات طاقة عالية [1].
الإلكترونات
يعتمد إنتاج حزم الإلكترونات المستعملة في العلاج بالإشعاعي على نفس المبدإ الذي يقوم عليه إنتاج الأشعة السينية، فبعد تحرير الإلكترونات من مداراتها بتسخين سلك معدني، يتم تسريعها إلى أن تصل إلى الطاقة المرغوب استعمالها في العلاج. وتتم عملية التسريع باستعمال مسرعات خطية، حيث تتّبِع الإلكترونات مسارًا مستقيمًا تتسارع فيه بفضل الطاقة التي تستمدها من موجات لاسلكية قصيرة ينتجِها ما يسمى بموجه الموجة. وعادة ما تستعمَل نفس الآلة من أجل إنتاج حزم الإلكترونات والأشعة السينية. حيث يوضع هدف في مواجهة الإلكترونات المُسَرّعة من أجل إنتاج الأشعة السينية، في حين تتم إزالتها في حالة إنتاج الإلكترونات [1].
أشعة غاما
تستعمل أشعة غاما في العلاج الإشعاعي باستغلال خاصية الانحلال الإشعاعي لبعض المواد المشعة. حيث تتحول نواة أصلية إلى نواة متولدة مثارة من خلال التحلل بيتا. ثم تتخلص النواة المثارة من الطاقة الزائدة من خلال بعث أشعة غاما (التحلل غاما). ويعتبر الكوبالت-60 المادة الأكثر استعمالًا نظرًا لميزاته التي تناسِب عملية العلاج الإشعاعي، حيث يملك طاقة عالية ونشاطًا إشعاعيًا كبيرًا بالإضافة لعمر نصف طويل نسبيًا (أكثر من خمس سنوات) [1].
يغلَّف المنبع المشع في كبسولة فولاذية مقاومة للصدإ، ويوضع داخل جهاز للعلاج الإشعاعي الخارجي مخصص لهذا الغرض. ويتكون الجهاز بشكل رئيسي من المنبع المشع، وحامل لهذا المنبع، بالإضافة إلى مسدد الحزم الذي يحدد الحقل الإشعاعي. يتموضع المنبع في حامل المنبع المصنوع من الفولاذ والرصاص من أجل منع الإشعاعات من التسرب خارجًا. ويمكن تحريك المنبع المشع نحو الفتحة التي ينبعث منها الإشعاع أثناء عملية العلاج بفضل جهاز تحريك يعمل ككابس (الشكل 4) [1].
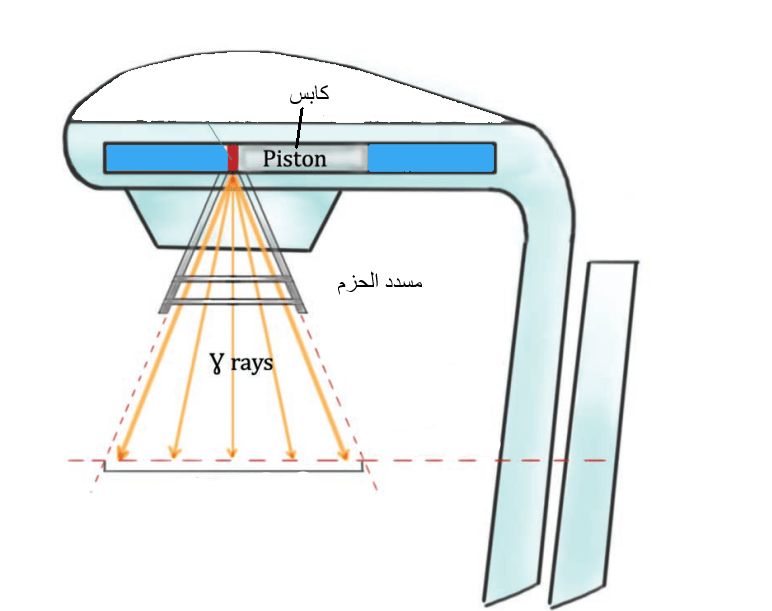
حاليًا، تم استبدال هذه الأجهزة بالمسرعات الخطية نظرًا لأن هذه الأخيرة أكثر عملية وأقل كلفة [1].
البروتونات والنيوترونات والأيونات الثقيلة
تستعمِل عدة مراكز في العالم الجسيمات الثقيلة، بما فيها البروتونات والنيوترونات والأيونات الثقيلة كالهيليوم والكربون، في العلاج الإشعاعي. وتتميز هذه الجسيمات بفعالتيها في علاج الورم السرطاني مع الحفاظ على الأعضاء المعرضة للضرر مقارنة بالإلكترونات والأشعة السينية وأشعة غاما. لكن كلفتها باهضة مقارنة بهذه الأخيرة[1].
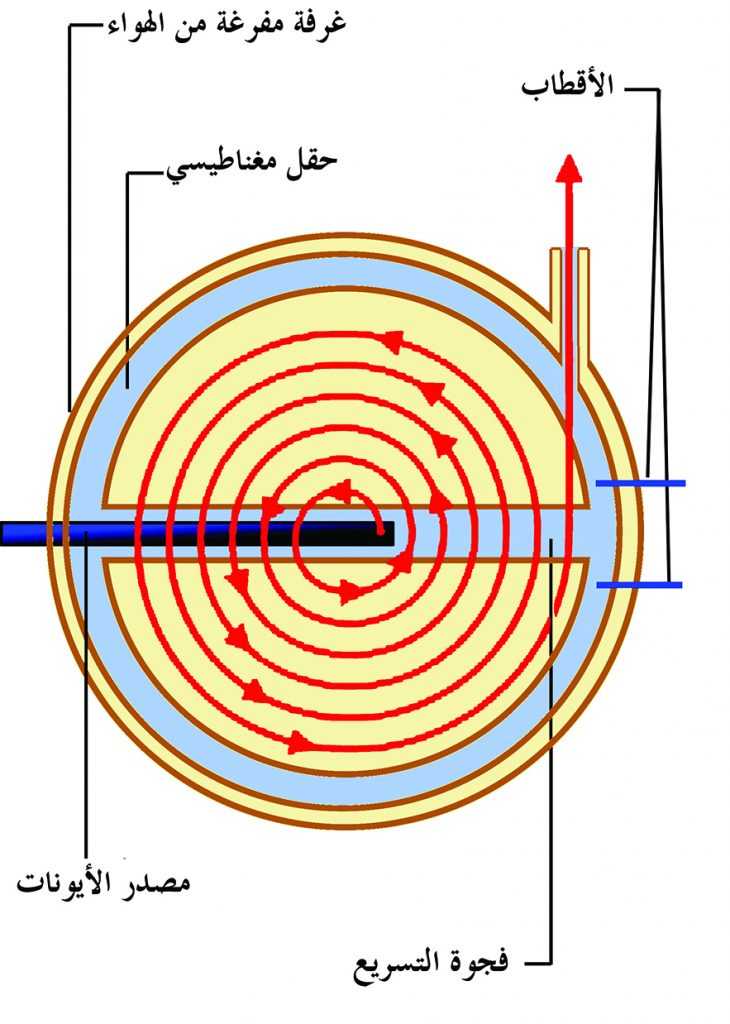
ومن أجل إنتاج هذه الجسيمات الثقيلة، يستخدَم المسرع الدوراني الذي يسرِّع الجسيمات على طول مسار لولبي. توجَه الجسيمات داخل غرفتين نصف دائريتين مفرغتين من الهواء وخاضعتين لمجال مغناطيسي ثابت. تفصل الغرفتان فجوة خاضعة لمجال كهربي. حيث يسرِّع المجال الكهربي الجسيمات، بينما يغير المجال المغناطيسي مسارها. وهكذا، فإن الجسيمات تنحرف داخل إحدى الغرفتين في مسار دائري. وحين تصل إلى الفجوة تتسارع إلى أن تتجاوزها، ثم تدخل الغرفة المقابلة -حيث تكون سرعة الجسيمات ثابتة- متتبعة مسارا دائريا إلى أن تعود للفجوة مرة أخرى فتتسارع من جديد. وهكذا دوايك إلى أن تصل إلى الطاقة المطلوبة (الشكل 5) [1].
في النهاية، مهما كان النوع المستخدم في عملية العلاج، فإن الدور الأهم في تحديد فعالية العلاج يبقى لعملية تخطيط العلاج.
المصادر
[1] Radiation Oncology Physics : A Handbook for Teachers and Students
سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.




التعليقات :