ما هو الدواء؟ وكيف يتم اكتشافه وتصنيعه وتطويره؟ ما الاختبارات التي تثبت فعالية الدواء؟ هل من آثار جانبية للدواء المُنتج؟ هل هناك إمكانية لتصنيعه في أشكال صيدلانية جديدة غير الموجودة في السوق الدوائية؟ أم يحمل هذا الدواء الجديد المطور تأثيرًا نوعيًا متميزًا يختلف عما هو متوافر حاليًا في الأسواق الدوائية؟ تابعوا سلسلة المقالات لسبر أغوار الصناعة الدوائية ومعرفة كيف تختار شركات الأدوية المركب الدوائي الأنسب ؟
محتويات المقال :
رحلة إنتاج المركب الدوائي الأنسب
ابتداءً من لحظة اكتشاف التأثير الدوائي الأولي للمادة في المختبر على حيوانات التجربة وصولًا للدواء بشكله النهائي كمستحضر صيدلاني جاهز للاستعمال، تستغرق هذه الرحلة عادةً سنوات طويلة مليئة بالاختبارات والتجارب بكل أنواعها. وتستهلك مبالغ طائلة أيضًا، لذلك تمول الشركات الدوائية العملاقة غالبًا هذه المراحل مع مراكز بحوث عالمية مختلفة، وتسبقها دراسات عميقة حول الجدوى الاقتصادية المأمولة من إنتاج هذا الدواء.
ما الذي يدفع شركات الأدوية لإنتاج دواء بعينه؟
لدينا ما يسمى “الحاجة الطبية غير المُلباة-Unmet medical needs”، أو (UMNs) ويعني هذا المصطلح وجود مرض ما بلا علاج فعال، وربما يكون هناك علاج ولكنه غير فعال عند بعض المرضى، وهذه الحاجة الطبية غير الملباة هي الدافع الأساسي لتمويل عملية اكتشاف دواء جديد.
لتبسيط الفكرة أكثر، هناك ما يُسمى بالأمراض الشائعة والأمراض اليتيمة والأمراض النادرة والأمراض الاستوائية المهملة.
يعاني الكثيرون من ارتفاع في ضغط الدم، وتوجد العديد من الأدوية التي تتعامل مع مثل هذا المرض الشائع. نذكر من تلك الأدوية مجموعات مثبطات (ACE)، وحاصرات بيتا (BB)، وحاصرات قناة الكالسيوم (CCB) وغيرها. لوجود كل هذه المجموعات من العقاقير، يصبح مرض ارتفاع الضغط حاجة مُلباة/مستوفاة بالفعل. أي لا توجد حاجة طبية قوية للتعامل معه.
أما بالنسبة لمرض مثل “مرض تشاجاس- Chagas disease”، وهو عدوى طفيلية قد تسبب للمصاب فشل قلب احتقاني، وفشل القلب الاحتقاني يحدث عندما لا تضخ عضلة القلب الدم كما ينبغي. عند حدوث ذلك، غالبًا ما يرتد الدم، ويمكن أن تتراكم السوائل في الرئتين، الأمر الذي يسبب الإصابة بضيق النفس. ويعتبر التشاجاس مرض استوائي مهمَل (NTD)، لكنه أيضًا حاجة غير ملباة، فلا يوجد عقار يتعامل مع هذه العدوى ويقضي عليها بشكل مباشر.
ماذا عن مرض السكري مثلًا؟ هل هو حاجة مستوفاة أم غير ذلك؟ فرغم أن هناك الكثير والكثير من الأدوية التي تتعامل مع هذا المرض، إلا أن بعض المرضى يعانون من حقن الإنسولين الضرورية لمصابين النوع الأول من هذا المرض. ولتجنب الألم الناتج عن هذه الحقن، سيكون الإنسولين الفموي شكل صيدلاني مرغوب أكثر بالنسية لأولئك المرضى، مما يجعله حاجة طبية غير مستوفاة.
لتحديد ما إذا كان هذا المرض هو حاجة طبية غير ملباة، يتوجب على شركات الأدوية البحث باستمرار في الشروط والعلاجات المتاحة والفجوات واحتياجات المرضى.
كيفية تحديد الهدف الدوائي الأنسب؟
بمجرد تحديد احتياجاتنا الطبية غير الملباة، يحين الوقت لبدء عملية اكتشاف المركب الدوائي الأنسب. وتكون البداية بالبحث عن المسارات البيولوجية المرتبطة بالمرض، لفهم آلية حدوثه. غالبًا ما تتحكم البروتينات في المسارات البيولوجية عبر الإنزيمات والمستقبلات.
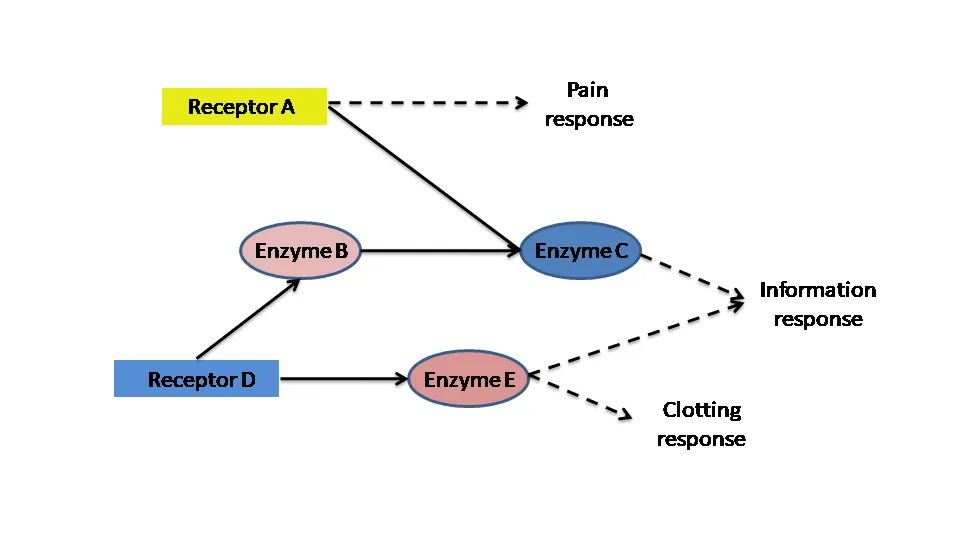
يعد اختيار الهدف الدوائي خطوة أساسية في رحلة اكتشاف الأدوية. فمن الناحية النظرية، إذا تمكنت من منع عمل إنزيم أو إغلاق مستقبل على طول المسار البيولوجي، فمن المحتمل أن يكون لديك تأثير علاجي على المرض. لنفترض أن لدينا مجموعة من الإنزيمات والمستقبلات كأهداف دوائية محتملة ومرتبطة باستجابات مختلفة، لكن ما يهمنا حقًا هو علاج التهاب ما. سنختار أحد هذه المركبات كهدف دوائي، ولكن كيف نختار هذا الهدف من بين الأهداف الدوائية المحتملة الكثيرة؟
يفضل بالطبع استخدام البروتينات المتصلة بمسار استجابة واحد فقط من بين الأهداف الموجودة. فمثلًا، يرتبط إنزيم B وإنزيم C بمسار الالتهاب فقط، فهذين الإنزيمين هما أكثر الأهداف جاذبية. بشكل عام، البروتينات هي الأقرب للاستجابة المناسبة، وبالتالي سيكون إنزيم C هو الاختيار الأفضل، ومن ثم يأتي فريق الأحياء الجزيئية لدراسة إنزيم سي وتحديد مدى صلاحيته ليصبح الدواء المستقبلي من عدمها.
اختبارات هامة لإثبات فعالية الدواء الأنسب على الهدف المطلوب
بعد اختيار الهدف، يتقدم فريق علم الأحياء من أجل الاختبار الكيميائي الحيوي، والذي يقيس نشاط البروتين المستهدف. يسمى هذا الاختبار “المقايسة-assay”، ويحدد عاملين أساسين لوصف الدواء.
- العامل الأول هو potency وتعني الفاعلية أو تركيز الدواء المطلوب للعمل على البروتين المستهدف. فهل سنحتاج إلى 5 مجم من المادة الفعالة أم 10 أم 500؟
- العامل الثاني هو Efficacy الفعالية وهو حجم/مقدار التأثير على الهدف. أي مقدار تأثير الـ 5 مجم تلك على الإنزيم، فهل تمنعه بالقدر الكافي ولكل درجات الإصابة؟
بعد أن تصبح نتائج هذه الاختبارات في متناول أيدي العلماء، سيختبر فريق الاكتشاف فاعلية وفعالية عدد كبير من الجزيئات ضد الهدف الدوائي المحدد، وتسمى هذه العملية “حملة الفرز-screening campaign”، حيث يتم اختبار أكثر من مليون جزيء باستخدام الحواسيب. من بين هذه الأعداد الهائلة، يرشح عدد قليل منها وربما مركب واحد ذو الفعالية الأقوى ضد المرض، وبذلك يتم الوصول للمُركّب الرئيسي للتقدم في عملية اكتشاف الدواء.
في هذا المقال تم توضيح ثلاثة عمليات رئيسية. أولاً، الهدف الدوائي وهو أساسي للتأثير على المرض. ثانيًا، المقايسة وهي اختبارات كيميائية حيوية تم تطويرها لمعرفة ما إذا كان بإمكاننا التأثير على هذا الهدف. وأخيرًا، فحص عدد كبير من الجزيئات إلى أن يتم الحصول على المركب الرئيسي الذي يفوز بحملة الفرز. تخضع كافة الأدوية الحديثة لهذه العمليات من أجل الوصول لعقار مناسب دون إهدار للموارد من وقت وتمويل.
المصادر

سعدنا بزيارتك، جميع مقالات الموقع هي ملك موقع الأكاديمية بوست ولا يحق لأي شخص أو جهة استخدامها دون الإشارة إليها كمصدر. تعمل إدارة الموقع على إدارة عملية كتابة المحتوى العلمي دون تدخل مباشر في أسلوب الكاتب، مما يحمل الكاتب المسؤولية عن مدى دقة وسلامة ما يكتب.

التعليقات :